グループ担当教員: 梶本 和昭 特任准教授
1. 研究の背景
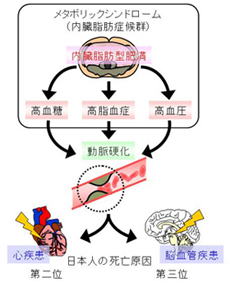
メタボリックシンドローム(metabolic syndrome;内臓脂肪症候群)とは、内臓脂肪の過剰な蓄積を伴い、高血糖・高脂血症・高血圧などのいわゆる生活習慣病の症状を2つ以上合併している病態を指します。生活習慣病は、いずれも動脈硬化を引き起こすリスクファクター(risk factor;危険因子)になりますが、メタボリックシンドロームのような複合的な病態では、個々のリスクファクターが相乗的に作用し、動脈硬化を発症する危険性が著しく増大すると言われています。さらに、動脈硬化は、日本人の三大死因のうち癌(第一位)を除く心疾患(第二位)と脳血管疾患(第三位)を引き起こす直接の原因となるため、早期の予防対策が最も重要と考えられています(メタボ健診:40〜74歳の保険加入者に義務付けられた特定健康検査・特定保健指導もその一つ)。
2. 研究の内容
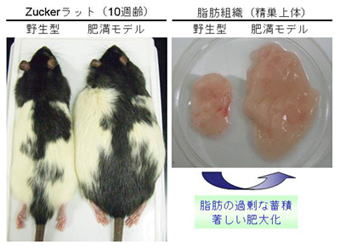
肥満とは、体内のエネルギー貯蔵庫である脂肪組織に過剰に脂肪が蓄積され、肥大化した状態を指します。肥満の脂肪組織では、脂肪細胞の数が増えるとともに、個々の脂肪細胞が巨大化することで組織の肥大化が起こります。上述した通り、肥満は動脈硬化などの重篤な疾患と密接に関わっているため、脂肪組織に関する研究は世界中で精力的に行われています。
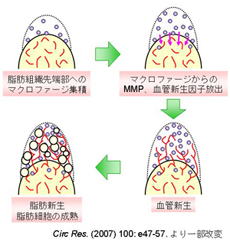
最近の研究で、脂肪組織の肥大化にはマクロファージ(macrophage;貪食細胞)の組織への浸潤と血管新生の誘導が深く関わっていることが報告されました(Circ Res. 2007; 100: e47-57)。このような現象は、腫瘍の増殖や動脈硬化の血管壁において認められる慢性の炎症性変化と類似したものであり、脂肪組織リモデリング(remodeling;再構築)とも呼ばれ、肥満の進展に血管が極めて重要な役割を担っていることを意味しています。
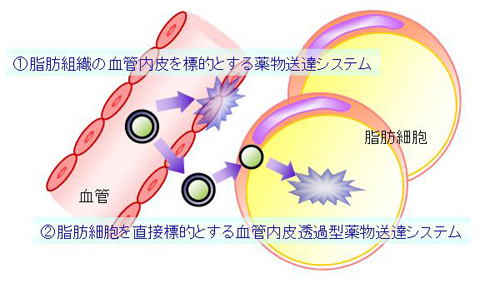
我々はこのような知見を踏まえ、脂肪組織の血管内皮細胞を標的とし、選択的な薬物送達を可能にする次世代のドラッグデリバリーシステム(drug delivery system, DDS;薬物送達システム)を開発することを目指して研究を行っています。さらに、従来のDDSでは不可能であった「血管壁を透過」して脂肪細胞に様々な医薬分子を直接送達できる世界初の革新的DDSの創出にも取り組んでいます。
また、DDSの開発と平行して、治療標的分子の同定を目指し、肥満に伴う脂肪組織の血管新生制御機構や脂肪細胞の機能制御機構を解明するための研究も行っています。
3. 研究の成果
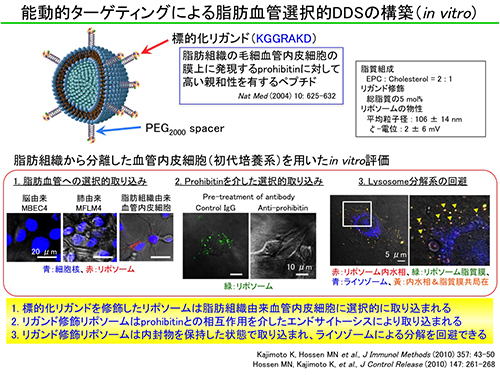
3.1 脂肪組織の血管を標的とする能動的ターゲティングシステムの構築
脂肪組織の血管に対する選択的な薬物送達には、「能動的ターゲティング」に基づく新たなDDS技術が不可欠です。我々は、2004年にKoloninらによって見出された脂肪組織の血管膜上に存在するprohibitinに対する高親和性ペプチド(KGGRAKD)を標的化素子として搭載したリポソームを構築しました。prohibitinは、全身の細胞において主としてミトコンドリア内膜に局在し、アポトーシスや細胞周期など多様な生体反応に関与することが知られています。脂肪組織の血管内皮細胞においてprohibitinが細胞膜上にも局在する機序や生理的意義は不明ですが、脂肪組織と他の臓器の血管を識別する上で極めて有用な特性と言えます。我々は、生体適合性脂質である卵黄レシチン(EPC)とコレステロール(Chol)を主成分とする粒子径100nm程度のリポソーム表面にポリエチレングリコール(PEG)を介してペプチドリガンドを修飾したリポソーム型ナノDDSを構築しました。また、我々は、血管生物学のエキスパートである北海道大学大学院歯学研究科の樋田京子先生らと連携し、マウスの脂肪組織から血管内皮細胞を95%以上の高純度で分離・培養する初代培養系を構築しました。この初代培養系を用いてリポソーム型ナノDDSの機能評価を行った結果、prohibitinとの特異的相互作用を介したエンドサイトーシスによって選択的に取り込まれること、さらに脂肪組織の血管内皮細胞に取り込まれたリポソームはリソソーム分解系を回避できること明らかとしました。
3.2 脂肪血管に対する能動的ターゲティングシステムのin vivoにおける最適化
次に、リガンド修飾リポソームを健常マウスに尾静脈より投与し、in vivoにおける送達能を評価しました。その結果、培養細胞での検討では高い細胞選択性を示したにも関わらず、in vivoでは脂肪組織の血管だけでなく非標的部位である肝臓などにも蓄積してしまうことが分かりました。そこで、リポソームの他臓器への非特異的な集積を最小限に抑えるとともに、脂肪血管へのターゲティング能を最大限に引き出すための最適化を試みました。様々な検討の結果、リポソームに長鎖のPEGを介してリガンドを修飾すると同時に、リガンドを付加していない短鎖のPEGを併せて搭載することで、他臓器への非特異的な集積が抑制され、脂肪血管への移行性が顕著に向上することを見いだしました。我々は、このリポソームをprohibitin-targeted nanoparticle(PTNP)と命名しました。

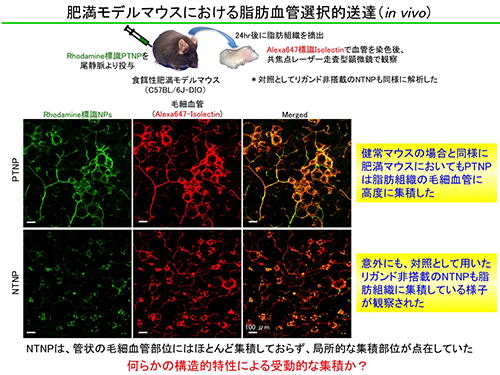
3.3 肥満の脂肪組織におけるナノDDSの受動的集積機構の発見
PTNPの肥満治療へ応用を目指し、高脂肪食を与えて肥満を誘導した疾患モデルマウスにPTNPを投与して体内動態を観察しました。その際、PTNPからリガンドを除去したnon-targeted nanoparticle(NTNP)を調製し、PTNPとの違いを比較しました。その結果、PTNPは肥満モデルマウスにおいても脂肪組織の血管に対して非常に高い選択的移行能を有することが明らかとなりました。一方、脂肪組織への移行性を示さないと考えられたNTNPもまた脂肪組織に顕著に集積するという非常に意外な結果が得られました。NTNPは能動的ターゲティングに不可欠な標的化リガンドを搭載していないため、受動的なメカニズムによって脂肪組織へ集積したと考えられます。
リポソームのようなナノDDSが受動的に生体内の特定の部位に集積する現象としては、がん組織のEnhanced permeability and
retention (EPR)効果が広く知られています。がん組織の新生血管内皮細胞間には数百ナノメートル程度の隙間があり、血管透過性が亢進しているために正常組織よりも高分子やナノ粒子が血管壁を透過しやすいという特性があります。そのため、PEG修飾によって血中滞留性を付与したリポソームは、全身を循環するうちに、次第にがん組織へ集積していきます。EPR効果を利用したがん組織への受動的ターゲティングは抗がん剤の副作用軽減と効果的な治療のために非常に重要な戦略であり、この戦略に基づいたDoxil(ドキソルビシン内包PEG修飾リポソーム製剤)は、現在、世界80カ国以上で使用されています。
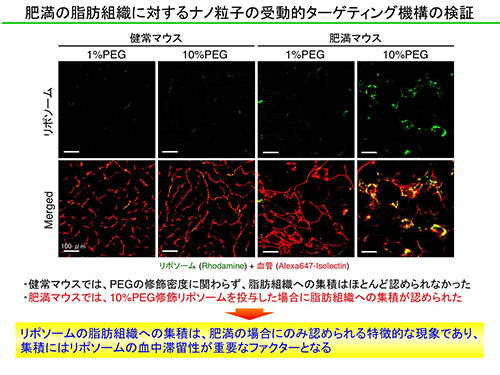
これまで、脂肪組織でEPR効果によるナノDDSの受動的な集積が認められたという報告はありませんでした。そこで、我々はPEGの修飾密度を変えることで血中滞留性の異なるリポソームを調製し、肥満モデルマウスに投与しました。その結果、血中滞留性の高いリポソームは脂肪組織へ集積しましたが、血中滞留性の低いリポソームの集積はほとんど認められませんでした。さらに、NTNPの脂肪組織への集積は、健常マウスでは認められないことも判明しました。
上述の通り、肥満動物の脂肪組織では、マクロファージなどの炎症性細胞の浸潤が亢進しており、慢性的な炎症が生じていることが知られています。つまり、肥満によって引き起こされる炎症によって脂肪組織内の血管透過性が亢進した結果、がん組織と同様にEPR効果によるナノDDSの受動的な集積が促進されたと考えられました。
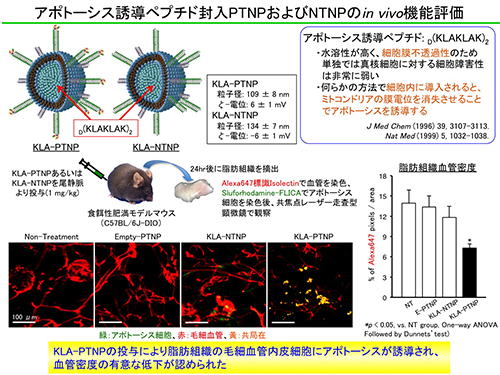
3.4 肥満治療への応用
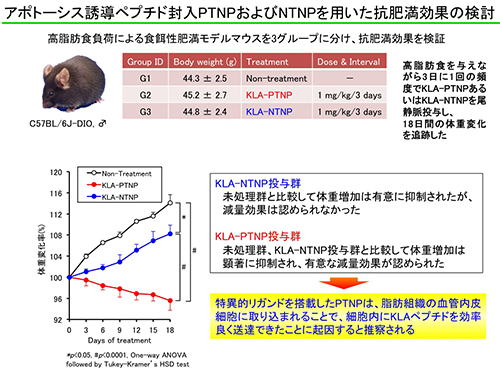
肥満の脂肪組織におけるEPR効果を介したリポソームの受動的な集積は、リガンドを搭載したPTNPの標的部位近傍への移行を促進することで、脂肪組織の血管内皮細胞への能動的な薬物送達を相乗的に高める効果があると期待されます。また、PTNPは脂肪組織の血管内皮細胞に取り込まれることが判明していますので、細胞内でのみ機能する薬物を用いることで、非特異的な副作用を回避することができると考えられます。そこで、細胞膜非透過性のアポトーシス誘導ペプチド(D(KLAKLAK)2)を内包したPTNP(KLA-PTNP)を調製し、肥満モデルマウスに投与したところ、脂肪組織の血管密度が有意に低下することが明らかとなりました。さらに、3日に1回の頻度でKLA-PTNPを反復投与することによって体重が有意に減少することも示されました。一方、リガンドを搭載していないNTNPの場合は、そのような効果は認められませんでした。これらの結果から、脂肪組織の血管を選択的に攻撃することで肥満治療が可能であること、さらに、PTNPのようなナノ送達システムを用いることで、従来の低分子医薬では実現できなかった安全かつ効果的な治療が可能になることを実証できたと考えています。
3.5 3T3-L1脂肪細胞への高効率siRNA導入法の確立
DDSの開発と平行して、脂肪細胞の培養モデルを用いた遺伝子機能解析による治療標的分子の探索も進めています。
3T3-L1細胞は、最も有名な脂肪細胞の培養モデルであり、脂肪細胞分化やエネルギー代謝のメカニズムを解明するための研究に広く用いられています。3T3-L1細胞は、線維芽様の細胞を増殖させた後、適切な条件で刺激することで脂肪を蓄積した脂肪細胞へ分化します。このようにして分化させた3T3-L1細胞はsiRNAなどの外来核酸の導入効率が著しく悪いことが知られています。ウイルスベクターやエレクトロポレーションのような方法では、核酸導入が可能であることも報告されていますが、作業の繁雑さや取扱いの面で様々な問題もあり、あまり汎用的ではありませんでした。そこで我々は、分化した3T3-L1細胞に市販のtransfection試薬を用いて効率良くsiRNAを導入し、標的遺伝子をknockdownするための技術の確立を目指して検討を行いました。
はじめに、常法に従って3T3-L1細胞を培養し、分化後にsiRNAをtransfectionしてknockdown効果を評価しました。標的遺伝子は、分化した脂肪細胞のマーカーとして知られるFabp4遺伝子を選択しました。Transfectionの48時間後にRT-PCR法によりFabp4 mRNAレベルを解析した結果、knockdown効果は全く認められませんでした。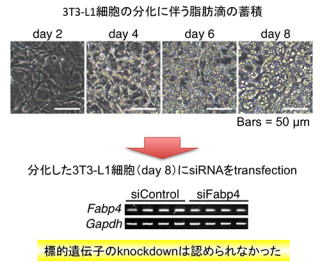
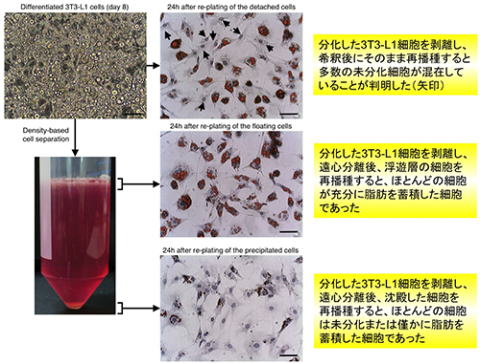
そこで、knockdownが認められない原因を明らかにするための検討を行いました。我々は、分化した3T3-L1細胞のsiRNA取り込み効率が低いのではないか?と考え、蛍光標識したsiRNAをtransfectionし、3T3-L1細胞への取り込みを共焦点レーザー走査型顕微鏡を用いて三次元的に観察しました。その結果、予想した通り、脂肪を蓄積した3T3-L1細胞にはsiRNAの蛍光はほとんど観察されませんでした。しかし、意外なことに、脂肪を蓄積した細胞から観察断面を上部にずらしていくとsiRNAの蛍光が多数観察され、その断面には脂肪を蓄積していない細胞が存在することが明らかになりました。
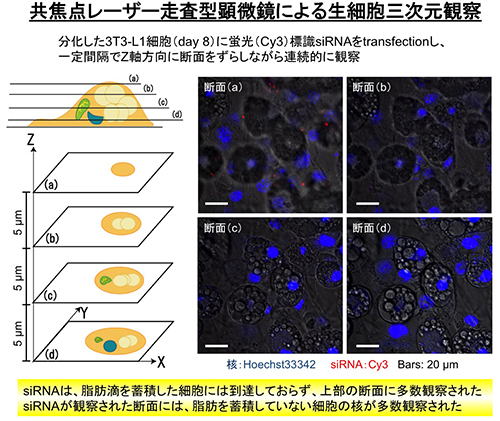
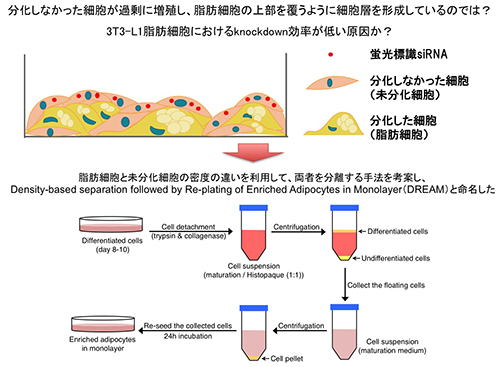
このことから、常法で培養した3T3-L1細胞の中には、分化しなかった細胞が混在しており、それらが過剰に増殖することで分化した脂肪細胞を覆うように細胞層を形成している可能性が考えられました。つまり、未分化な細胞にsiRNAがトラップされ、脂肪細胞まで到達していないために、knockdown効果が得られなかったのではないかと考え、この仮説を検証するための検討を行いました。
脂肪細胞と未分化細胞の決定的な違いは「脂肪を蓄積しているか否か」にあります。脂肪を蓄積した細胞は、未分化細胞よりも密度が小さくなる(油が水に浮く)ため、密度の違いを利用して脂肪細胞と未分化細胞を分離する手法(Density-based
separation followed by re-plating of enriched adipocytes in monolayer;
DREAM)を考案しました。その結果、常法に従って培養した3T3-L1細胞には、分化した細胞だけでなく、多数の未分化細胞が混在していることが明らかになり、脂肪を充分に蓄積した細胞を高純度に分離することにも成功しました。
このような未分化細胞の混在という問題がこれまでほとんど取り沙汰されてこなかった要因は観察の仕方にあると考えられます。細胞培養の実験では、観察の際に倒立型の位相差顕微鏡を用いるのが一般的ですが、細胞を下から観察するために、脂肪細胞の上部を覆っている未分化細胞の存在に気付きにくいと考えられます。
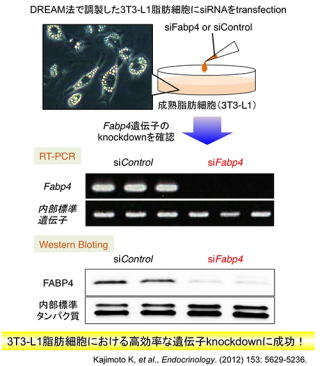
そこで次に、DREAM法で調製した3T3-L1脂肪細胞にsiRNAをtransfectionして標的遺伝子のknockdownを評価しました。検討に用いたsiRNAとtransfection試薬は最初の検討で全くknockdown効果が認められなかったものと同じものを使用しました。Transfectionの48時間後にRT-PCRとWestern blottingによりFabp4 mRNAおよびFABP4タンパク質レベルを解析した結果、いずれも顕著なknockdownが認められました。
DREAM法で調製した3T3-L1脂肪細胞では、Fabp4以外にも様々な遺伝子の発現を抑制できることも確認しており、任意の標的遺伝子の機能解析が可能になりました。
現在、この手法を用いた遺伝子機能解析により肥満治療のための標的分子の探索と分子機構の解明を進めています。
4. 今後の展望
これまでの成果をさらに発展させ、外見では判断できない「隠れ肥満」の超早期診断法や超低侵襲な肥満症治療法の実用化を目指した研究を展開していきたいと考えています。