北海道大学大学院 薬学研究院 衛生化学研究室
〒060-0812 北海道札幌市北区北12条西6丁目
tel.011-706-3243 fax.011-706-4990
研究概要Research
3. TYK2の新たな機能解明
Study 3: Discovery of the novel functions of Tyrosine Kinase 2 (TYK2).
生体における慢性化した炎症反応ががん・自己免疫疾患・生活習慣病を含むさまざまな疾患発症と密接な関連をもつことが近年注目されており炎症反応制御の根底にある分子機構の理解は重要です。わたしたちは炎症反応におけるTyrosine kinase 2 (TYK2)の役割に着目しています。TYK2はJAKファミリーに属する非受容体型チロシンキナーゼであり、IL-12、IL-23、IFN-alpha等のサイトカイン受容体に会合し、それら受容体下流の細胞内シグナル伝達活性化を仲介する役割をもちます。これによりヘルパーT細胞分画の分化の方向付けや、ナチュラルキラー細胞からのIFN-gamma産生などに役割をもつことが現在までに判明しており、ウイルスや細菌など外来抗原に対する防御応答において重要なタンパクであることが明らかとされてきました。
TYK2がシグナル伝達に関わるサイトカインとして,IL-6,IL-12,IL-10,IL-13,IFN-α/βなどが多くのサイトカインが挙げられますが、遺伝子欠損マウスが致死的な表現型を示すJAK1やJAK2,あるいは免疫不全の表現型を示すJAK3に比べて,TYK2欠損マウスは出生および成長に明らかな異状は認められず、IL-12シグナルやIFNシグナルの部分的な抑制が初期に同定された表現型でした。しかしながら2006年に、皮膚・肺における反復性感染症、アトピー性皮膚炎、血清IgEの高値を3主徴とする高IgE症候群患者において、ヒトTYK2欠損が原因とされる一例が発見・報告されました。TYK2が関わるサイトカインシグナル伝達の異常によりヒトの免疫不全症を発症することから、ヒトにおけるTYK2がマウスにおいてよりも免疫系へ大きな寄与をもつと考えられるようになりました。
また近年ヒト疾患の原因遺伝子同定を志向したゲノムワイド関連解析の結果が多数報告されている中、TYK2のアミノ酸置換を伴う一塩基多型 (SNP)が、全身性エリテマトーデス、多発性硬化症、1型糖尿病の疾患感受性に影響することも報告され、ヒトTYK2遺伝子のSNPが持続的炎症を伴う自己免疫疾患の発症頻度と関連することが示唆されています。
しかしながら、これらのヒト疾患発症調節におけるTYK2関与の分子機構について、現状では不明点が多く残されています。
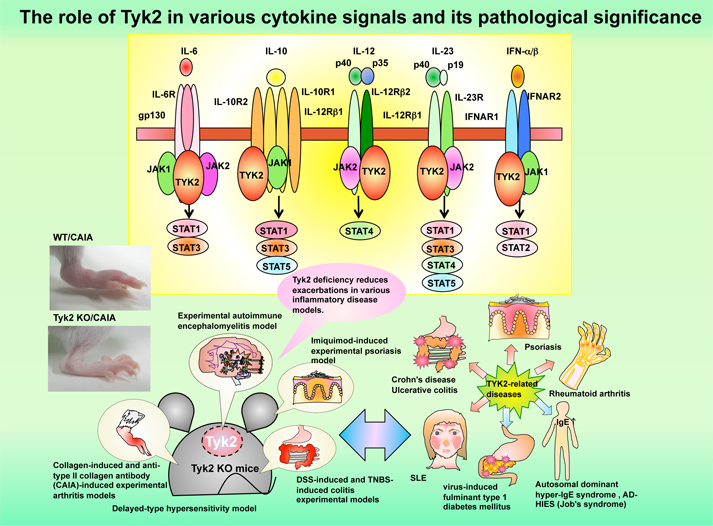
わたしたちはTYK2の新たな生理的役割を同定するために、欠損マウスを用いて実験的疾患モデルの解析を行ってきました。その結果、遅延型過敏症・乾癬様皮膚炎・炎症性腸疾患・関節炎等の持続的炎症を伴うさまざまな疾患モデルにおいて、TYK2が促進的に寄与することを明らかにし報告しました。これらの結果は、TYK2がもつ生理的役割が、従来の解析結果から推測される以上に多岐にわたることを示しています。
TYK2が介在する炎症疾患促進機構について今後も研究を進めることで、従来明らかではなかったTYK2の生理的役割を同定できると考えられます。本研究の進展により、自己免疫疾患や生活習慣病など持続的炎症と関連する疾患の治療や予防法開発に際し、TYK2を標的とすることの有用性を示す知的基盤を得られるものと考えられます。図にはTYK2を介するサイトカインのシグナル伝達系と実験的関節リウマチモデルでのTYK2の働きを示しています。
A key focus of interest has been the close relationship between chronic inflammatory responses in living organisms and the development of diseases including cancer, autoimmune diseases, and lifestyle-related diseases, as well as understanding the molecular mechanism underlying the regulation of the inflammatory response. Our focus is the role of TYK2 in inflammatory response. TYK2 is a non-receptor type tyrosine kinase that belongs to the JAK family. It binds to IL-12, IL-23, and interferon (IFN)-α cytokine receptors and mediates activation of intracellular signaling pathways. These characteristics are associated with Th cell differentiation and IFN-γ production from natural killer cells. TYK2 is considered an important protein for defense responses to viruses, bacteria, and other foreign antigens. It is involved in the signaling of many cytokines including IL-6, IL-12, IL-10, IL-23, and IFN-α/β. However, in contrast to JAK1 and JAK2, where gene-deficient mice exhibit a lethal phenotype, or JAK3 gene-deficient mice that exhibit immunodeficiency, TYK2-deficient mice do not have clear abnormalities in birth or growth, and the phenotype is associated with early identification of partial IL-12 and IFN-signaling control. However, in 2006, a case was reported in which human TYK2 deficiency was the cause of the autosomal recessive hyper IgE syndrome. As abnormalities of cytokine signaling involving TYK2 were found to cause immunodeficiency in humans, the contribution of TYK2 to the human immune system is considered larger than that in the murine immune system. However, the molecular mechanism for TYK2 involvement in the regulation of human disease development is not clear.
To identify a novel physiological role of TYK2, we have studied an experimental disease model using TYK2-gene-deficient mice. Thus, we discovered that TYK2 is involved in a number of animal disease models that accompany ongoing inflammation, including delayed hypersensitivity, psoriasiform dermatitis, inflammatory bowel disease, and arthritis. These results suggest the the physiological role of TYK2 is more diverse than was anticipated based on previously available study results.
We think that further investigation of the mechanism that facilitates TYK2-mediated inflammatory diseases will reveal a novel physiological role of TYK2 and therapeutic potential of TYK2 inhibition in human diseases. The Figure below shows the signaling pathways of TYK2-mediated cytokines and the effects of TYK2 in an experimental model of rheumatoid arthritis.
4.マスト細胞/好塩基球活性化分子機構の解明および新規アレルギー治療標的分子の探索
Study 4: Investigation of molecular mechanisms in mast cell/basophil activation and identification of new therapeutic candidates for allergy.
アレルギーは外来抗原の排除システムである免疫応答が過剰に起きる結果、生体内で様々な不利益反応が生じる疾患であり、近年、日本人の2人に1人は何らかのアレルギー疾患にかかっています。代表的なアレルギー疾患としては喘息、アトピー性皮膚炎および花粉症が知られています。また、近年、学校給食で問題が取り沙汰されている食物アレルギーは非常に危険なアナフィラキシー反応を誘発することで広く知れており、アレルギー疾患の根治は現代社会が早急に対処しなければならない課題の一つです。
アレルギーの歴史を遡ると、古くは紀元前にアナフィラキシー反応の記録が存在します。アレルギーとはギリシャ語の変わった「allos」+反応「ergon」という言葉に由来し、1906年にオーストリア人のクレメンス・フライハー・フォン・ピルケにより提唱されました。しかし、どのような物質がアレルギー反応に関わるかは長らく不明でしたが、1966年にジョン・ホプキンス大学の石坂公成・照子博士らによってアレルギーを引き起こす物質がレアギン(その後、「IgE」と命名)であることが証明されました。
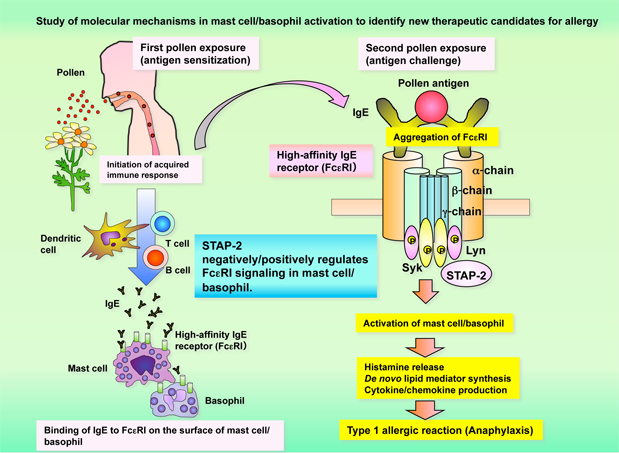
マスト細胞/好塩基球は細胞表面上に高親和性IgE受容体(以下FcεRI)を発現しています。抗原特異的IgEが結合したFcεRIが多価抗原により架橋されるとマスト細胞は活性化され、ヒスタミンを始めとした様々な化学伝達物質、プロスタグランジンやロイコトリエンに代表される脂質メディエーター、細胞内プロテアーゼおよびサイトカイン/ケモカインを産生・放出します。その結果、血管透過性亢進、気管支平滑筋収縮、粘液分泌亢進、炎症細胞の局所浸潤の誘導が起こり、さらに症状が悪化すると、血圧低下や意識障害を引き起こし、最悪の場合、死亡するケースもあります。
FcεRIはIgEとの結合に関わるα鎖、細胞シグナル調節に関わるβ鎖およびγ鎖より構成されています。FcεRIが架橋されるとSrcファミリーチロシンリン酸化酵素Lynによりβ鎖およびγ鎖に存在する免疫受容体チロシン活性化モチーフ (Immunoreceptor tyrosine-based activation motif: ITAM)中のチロシン残基がリン酸化され、Lynおよび他のチロシンリン酸化酵素Sykが受容体に集積し下流シグナルが誘導されます。一連のマスト細胞シグナル伝達には、リン酸化酵素のみならず様々な細胞内アダプター分子が重要な役割を担っています。
STAPファミリーアダプタータンパク質にはSTAP-1とSTAP-2が含まれます。STAP-2は、研究概要2でも示されているように、サイトカインシグナル伝達に関わる分子として当研究室で同定した新規細胞内アダプタータンパク質です。これまで我々はSTAP-2過剰発現ラットマスト細胞株RBL-2H3細胞およびSTAP-2欠損マウス由来培養マスト細胞を用いた研究より、STAP-2がFcεRIを介したシグナル伝達を負に制御していることも報告ました。さらに、最近、我々はFcεRIシグナルに対して好塩基球とマスト細胞ではSTAP-2の関与が異なることも報告しています。しかし、マスト細胞と好塩基球でなぜSTAP-2によるFcεRIシグナルの調節が異なるのか、STAP-2による負や正の調節はFcεRIシグナル選択的な現象なのか、さらにはアレルギーの病態形成へどのように関与しているのかなど、未だ多くの疑問が存在します。一方、同じファミリーに属するSTAP-1はマスト細胞や好塩基球を含め、様々な免疫細胞に強く発現しており、マスト細胞や好塩基球の機能にSTAP-1が何らかの影響を与える可能性が考えられます。しかし、未だSTAP-1がマスト細胞や好塩基球のFcεRI依存性活性化機序に対して何らかの機能を果たすか、さらにアレルギー病態形成におけるSTAP-1の役割は全く解明されていません。さらに、STAP-1およびSTAP-2がアレルギー病態形成に関わる抗原特異的IgEやその他の抗体産生に対してどのように影響するのかについても不明です。我々は現在、STAP-1およびSTAP-2のアレルギー反応に対する作用機序の全容解明し、新たなアレルギー治療標的分子の同定を目標に研究を行なっています。
Allergy (Greek allo “other, strange” + ergon “activity) is an abnormal immune reaction of body. Allergic disorders include bronchial asthma, atopic dermatitis and pollinosis. Also, food allergy is a food allergen-induced anaphylaxis – a life-threatening allergic reaction - and a public health issue with significant increased number of patients in the past decade. Therefore, it is needed to deal with permanent cure for the allergic diseases.
The concept of “Allergy” was initially introduced by Dr. von Pirquet in 1906. In 1996, Drs. Ishizaka discovered the reagin, which recently calls “IgE”, for one of immunoglobulins to be involved in allergic reactions.
Mast cell and Basophil (MC/Basophil) express high-affinity IgE receptor (FcεRI) on their surface. When antigen-specific IgE-bound FcεRI on MC/Basophil is aggregated by multivalent antigens, the MC/Basophil are activated. After activation, MC/Basophil release/produce chemical mediators (histamine and serotonin), proteases, lipid mediators (prostaglandin and leukotriene) and cytokines/chemokines, resulting in increased vascular permeability, bronchial smooth muscle contraction, increased mucus production, immune cell infiltration, decreased blood pressure and anaphylaxis. Therefore, it is important to figure out the detail mechanisms of MC/Basophil activation for generation of new allergic therapy/medicine.
FcεRI consists of an IgE-binding α subunit, a signal-modulating β subunit and two signal-generating γ subunits. Aggregation of IgE-bound FcεRI by multivalent antigen results in activation of Lyn, a Src family tyrosine kinase. Lyn phosphorylates tyrosine residues within Immunoreceptor tyrosine-based activation motifs (ITAMs) in β and γ chains. This phosphorylation leads to the recruitment of Lyn to the β chain and a protein tyrosine kinase (PTK), Syk, to the γ chain. Then other PTKs are recruited to the receptor complex to activate several signaling pathway. Several adaptor proteins are also recruited to the complex and required for FcεRI-dependent signal transduction in MC/Basophil upon stimulation.
STAP family consists of two members, STAP-1 and STAP-2. STAP-2, cloned in 2003, is an important adaptor molecule to regulate STAT3-mediated signaling pathway as shown in Study 2. We have also reported that STAP-2 negatively regulates FcεRI-dependent signal transduction in MCs using STAP-2-overexpressing RBL-2H3 cells and STAP-2-deficient bone marrow-derived cultured mast cells. Recently, we have reported that STAP-2 positively regulates FcεRI-dependent signal transduction in basophils. However, we have several questions: 1) How to control negative/positive regulation of FcεRI signaling by STAP-2 in MC/basophil. 2) Role of STAP-2 for allergic diseases. 3) Functional role of STAP-1 in FcεRI-mediated MC/basophil activation as well as pathogenesis of allergic diseases. 4) Effect of STAP-1 and STAP-2 on antibody, especially antigen-specific IgE, production in B cells. We are studying to figure out detailed contributions of STAP-1 and STAP-2 to allergic reactions as well as to find new candidates of signal molecules for treatment of allergic diseases.
- 研究概要Research
- はじめにIntroduction
- 1.インターロイキン6(IL-6)のシグナル伝達分子STAT3活性化制御機構の解析Study 1: Controlling mechanism of a signaling molecule, STAT3 by interleukin (IL)-6
- 2.アダプター分子STAP-2による免疫シグナル調節機構の解析Study 2: Mechanism of signal regulation in the immune system by an adaptor protein, Signal-Transducing Adaptor Protein-2 (STAP-2)
- 3.TYK2の新たな機能解明Study 3: Discovery of the novel functions of Tyrosine Kinase 2(TYK2).
- 4.マスト細胞/好塩基球活性化分子機構の解明および新規アレルギー治療標的分子の探索Study 4: Investigation of molecular mechanisms in mast cell/basophil activation and identification of new therapeutic candidates for allergy.
- 5.がん免疫作用機構の解明と新たな抗がん剤の開発Study 5: Study of mechanism in cancer immunity and development of new anti-cancer drugs.