有機化学からの創薬へのアプローチ〜論理的な医薬分子設計とその効率的な合成〜
薬はある特定の生体分子(創薬標的タンパク質)に選択的に結合することでその薬理活性を発現します。ほとんどの薬は低分子有機化合物であり、一方、その標的タンパク質は高分子有機化合物です。従って、両者の結合とそこから生じる薬理作用は当然有機化学に基づき解析・理解できるはずです。このような考えに基づき、私達は新薬創製のための有機化学、即ち、薬となり得る低分子化合物の論理的な分子設計とその効率的な合成に取り組んでいます。1. 配座制御に基づく医薬分子設計法の開発と応用
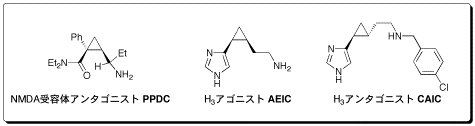
ヒトゲノムの解読やバイオインフォマティクスの進歩に伴い創薬標的タンパク質の迅速な同定が実現しつつある一方で、”創薬標的タンンパク質に選択的に作用する医薬を如何に効率よく創製するか”が、創薬における大きな課題となっています。医薬が標的タンパク質に高選択的に結合するためには、官能基を結合に適するような三次元配置(活性配座)に制御することが有効です。そこで私たちは、最小の炭素環で立体的に自由度のないシクロプロパンは配座制御に効果的に活用できると考え、シクロプロパンの構造特性に基づく医薬分子設計のための新しい配座制御法を開発しました。本配座制御法を神経伝達物質受容体に対するリガンドの設計へと応用した結果、新しいNMDA受容体アンタゴニストPPDC、及び初めてのヒスタミンH3受容体高選択的アゴニストAEICなどの開発に成功しました。これらはアルツハイマー病や副作用のない睡眠薬としての利用が期待されています。
このようなシクロプロパンを活用する分子設計法をさらに発展させ、ペプチドミミックの設計へと展開しています。生理活性ペプチドは様々な疾患の治療に有効と考えられますが、安定性・吸収性・体内動態等の問題から医薬としての利用が妨げられています。従って、医薬利用可能なペプチドミミックの開発は創薬化学における最重要テーマの一つとなっています。 シクロプロパンを基本骨格する有用なペプチドミミックの創製を目指して、現在研究を進めています。
2. 細胞内Ca2+動員系機能分子の創製
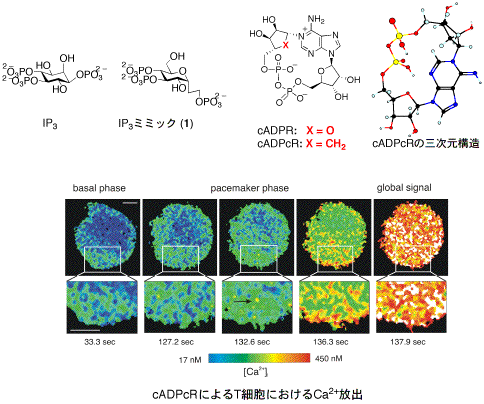
従来の主な医薬は、細胞間の情報伝達を担うタンパク質、例えば細胞膜上の受容体やこれら受容体に対する伝達物質の代謝酵素等を標的として結合しますが、薬理活性は細胞内シグナル伝達系を介して発現します。従って、細胞内シグナル伝達系の機能タンパク質に直接作用する化合物を見出せれば、新薬の創製が期待できます。即ち、細胞内シグナル伝達タンパク質は新しい創薬標的となり得るのです。このような考えから、細胞内Ca2+動員セカンドメッセンジャーであるIP3やcADPRの構造をもとにした薬理活性分子の合理的設計と合成に取り組んでいます。例えば、グルコースがIP3と同様ないす型6員環構造を持つことに着目して設計したC-グルコシド型IP3ミミック1は、IP3受容体に作用してIP3様の顕著なCa2+動員活性を示すことが判りました。
一方、cADPRは極めて不安定な化合物であるため、その機能解明が進んでいません。これをを踏まえて、不安定性の要因であるN1-リボース部環内酸素原子を炭素で置換した類縁体cADPcRを設計し、その全合成に成功しました。cADPcRは代謝的にも化学的にも安定なcADPRの活性等価体であることが明らかとなり、現在、cADPcRをバイオロジカルツールとして用いる生物学的研究が国内外で活発に進められています。