独自の機能性脂質ライブラリの開発
脂質ナノ粒子(lipid nanoparticle; LNP)はmRNAなどの核酸を効率的に標的細胞へ導入する技術の1つとして研究されています。効率的な導入には、搭載分子の保護や組織分布、細胞選択性、細胞内動態(エンドソームからの脱出)、搭載分子の放出、などの各過程を大幅に改善する必要があり、LNP構成脂質の化学構造が重要な役割を果たしています。
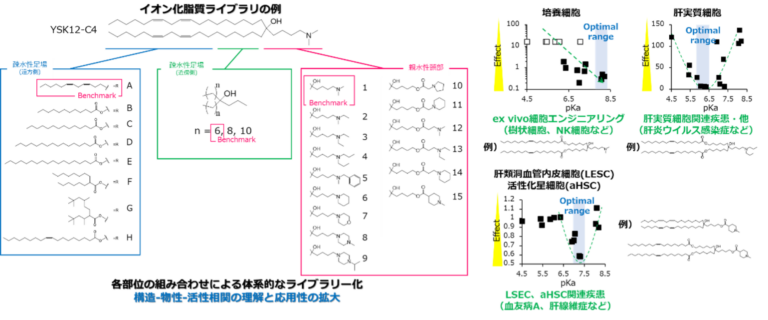
本研究グループでは、これまでにpH低下に応答して正に帯電するイオン化脂質を中心に、複数の独自の脂質ライブラリの構築を進めてきています(図・左)。体系的なライブラリ化により構造-物性-活性相関を理解すると共に、標的とする組織・細胞の拡張に成功しています(図・右)。また、詳細な分子構造改変により競合技術と比較して優れた核酸(siRNA、mRNA)導入能や安全性を示すLNP製剤の開発にも成功しています。現在は搭載分子の特性、生体成分との相互作用、さらには製剤安定性にも着目した分子設計を進めています。また、イオン化脂質に加えて、エンドソーム脱出の促進あるいは体内動態の変化を引き起こす新規の機能性脂質成分の開発も行っています。
開発した脂質技術を基に、多くのアカデミアとの共同研究による多様な疾患治療への応用研究を進めるとともに、国内外のベンチャー企業・製薬会社との産学連携による技術の社会実装へ向けた取り組みを精力的に進めています。
ナノ粒子-生体分子相互作用に基づく脂質ナノ粒子の体内運命制御
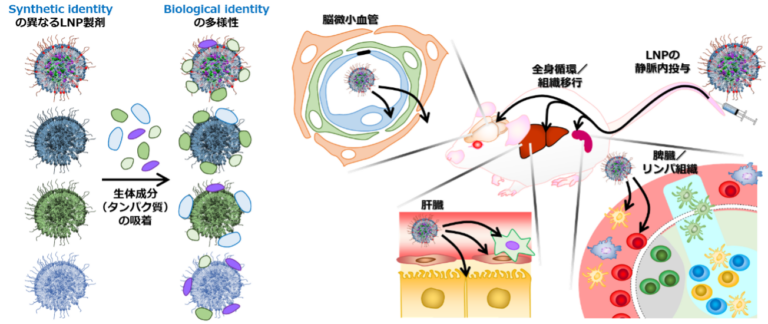
生体に投与されたナノ粒子はその化学的・物理的特性(synthetic identity)に応じてタンパク質を中心とする生体成分と相互作用を引き起こし、界面に生体成分の相(biomolecular corona; BC)を形成することが知られています。ナノ粒子はBCで覆われた状態(biological identity)で生体システムに認識されるため、BCの特徴によって組織分布などの体内運命が左右されます(図・左)。LNPにおいてはアポリポタンパク質E(ApoE)の吸着による肝実質細胞への移行メカニズムが広く知られています。近年はApoE以外の内因性リガンドとして機能するタンパク質に関する報告がなされてきていますが、LNPの構成脂質分子構造や脂質組成、また、その結果としてのLNP構造や膜物性とBCの関係性については多くの謎が残されています。本研究グループではイオン化脂質の構造・特性や脂質組成とLNPの細胞指向性に着目した研究を進めており、肝実質細胞をはじめ、他の肝臓非実質細胞(類洞血管内皮細胞や活性化星細胞など)や脾臓免疫細胞(樹状細胞、B細胞など)などへ核酸を導入可能なLNPを見出すことに成功しています。現在は各細胞指向性LNPのBCの解析を進めると共に、脳組織などの導入困難な組織あるいは細胞種への適用拡大を目指した研究を進めています(図・右)。
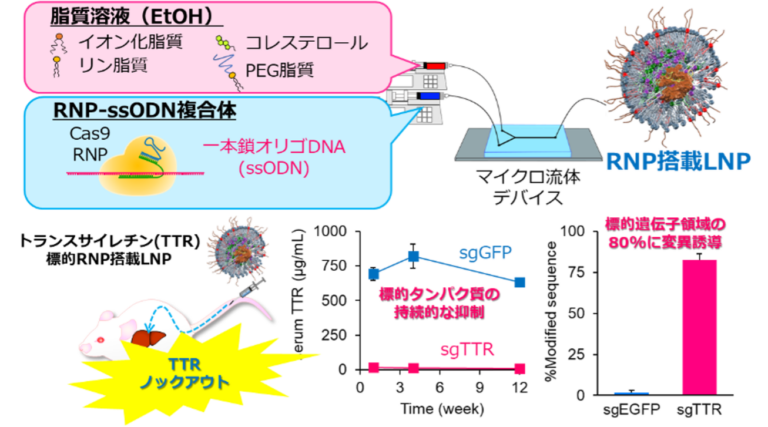
ゲノム編集治療を実現する脂質ナノ粒子製剤の開発
ゲノム編集は任意のゲノム領域を標的として変異導入、修復、遺伝子挿入やエピゲノム編集を可能とする技術であり、特にCRISPR/Casシステムが発見されてから様々な産業分野で不可欠な技術となっています。医療分野では特に難治性の遺伝性疾患に対する根本治療法として非常に大きな期待が寄せられており、海外では既に臨床試験が精力的に進められています。本研究グループではCRISPR/Casシステムに着目し、mRNA/sgRNA送達による効率的なゲノム編集を誘導可能なLNP製剤の開発を進めています。また、活性本体であるRNA-タンパク質複合体(ribonucleoprotein; RNP)導入可能なLNP製剤の開発にも精力的に取り組んでおり、これまでにin vitroおよびin vivoにおいて非常に高効率な遺伝子ノックアウトの誘導に成功しています(図)。現在は本技術を基に標的細胞の適用拡大や搭載タンパク質の拡張に向けて検討を進めています。