ミトコンドリア標的型ナノ医薬品の創製
近年、ミトコンドリアと様々な疾患との関連が明らかとなってきており、本オルガネラを標的とした薬物治療が注目されています。ミトコンドリアは非常に多様な機能を有したオルガネラであり、その機能の欠損によって、疾患が発症する事が報告されています。例えば、エネルギー産生の中核となる電子伝達系の機能低下による糖尿病、アポトーシスの制御異常による癌、心筋梗塞、ミトコンドリアDNAの変異によるミトコンドリア遺伝病などが挙げられます。これらの疾患治療を実現させるためには、ミトコンドリアへ治療用分子を送達させる必要があります。そのため、世界中の研究者が、今までは未開の地であったミトコンドリアを標的とした薬物送達研究を展開させています。
私たちの研究室では、ミトコンドリアが細胞内で活発に融合・分裂を繰り返し、相互に生体分子(核酸、タンパク質など)を共有している点に着目し、ミトコンドリアと膜融合可能なナノカプセル“MITO-Porter”を考案、100種以上の組成の中からミトコンドリア高融合性ナノカプセルの同定に成功しております(特許 第5067733号)。膜透過性ペプチドR8 (正電荷)が表面修飾されているMITO-Porterは、マクロピノサイトーシスを介して細胞内に取り込まれ(➀)、静電的相互作用を介して負電位を有するミトコンドリアと結合し(➁)、膜融合を介して内封分子をミトコンドリアに送達します(➂)。MITO-Porterを用いた戦略は、薬物を封入したナノカプセルが膜融合を介してミトコンドリア内へ薬物を送達するため、薬物の種類やサイズによらない送達が可能となります。私たちはこれまでに、MITO-Porterが多種多様な分子(タンパク質、酵素、オリゴ核酸、RNA、pDNA、超分子、難水溶性分子、など)を生細胞のミトコンドリアへ送達する事を確認しています(Yamada Y. et al, Adv Drug Deliv Rev. 2020;154-155:187-209)。
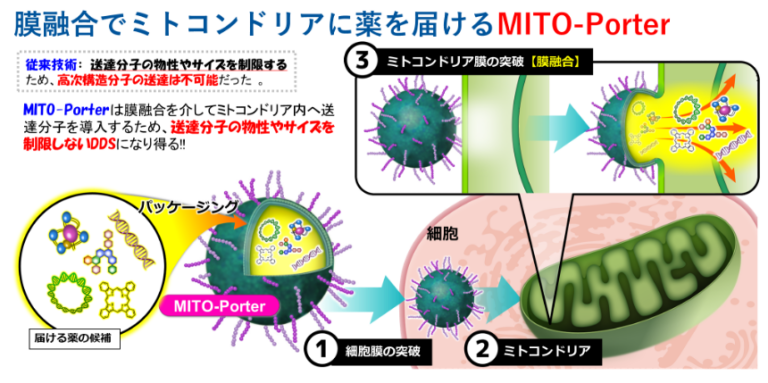
ミトコンドリア標的型Drug Delivery System (DDS)による疾患治療のProof of Concept (POC)を取得するため、in vivo適応型DDSの開発、病態モデルを用いた研究を進めています。現在は、ミトコンドリアを標的とした薬物送達療法、遺伝子治療、細胞治療、虚血性疾患治療、癌治療を目標として研究を展開しています。近い将来に、私たちの創製した薬物送達システムが、ミトコンドリア関連疾患で苦しむ多くの患者さんの助けになる事を願い、今後も精力的に研究を続けていきたいと思います。
ミトコンドリア遺伝子治療の実現を目指した研究
有用なキャリアが多数開発されている核・細胞質を標的とした遺伝子治療研究では、目的遺伝子を導入する遺伝子送達療法、またはオリゴ核酸を用いた遺伝子修復治療やアンチセンス治療、などの多数の実施例が報告されています。これらのコンセプトはミトコンドリアへの適応も可能ですが疾患治療に関する報告は皆無であり、遺伝子治療を実現するミトコンドリアDDSの開発に大きな期待が寄せられています。ミトコンドリア遺伝病はmtDNAの変異・欠損が原因であるが、現在の治療法はビタミン剤などを継続的に投与し、ミトコンドリア機能を補助する対症療法が主流です。私たちは、これまでの治療法に代わる根本治療として注目されているミトコンドリアを標的とする遺伝子治療の実現を究極の目標に据え、MITO-Porterシステムを基盤とし、「mtDNAを標的とする機能性分子送達」 (Yamada Y. et al, Biomaterials 2012; 33: 1589-1595)、「ミトコンドリア発現DNAベクターの開発」 (Ishikawa T. et al, J. Control. Release 2018; 274: 109-117)、「ミトコンドリアを標的とする核酸送達療法」 (Kawamura E. et al, Mol. Ther. – Nucleic Acids 2020; 20: 687-698)を中心に研究を展開してきました。ここでは、核酸送達療法に関する研究を紹介します。
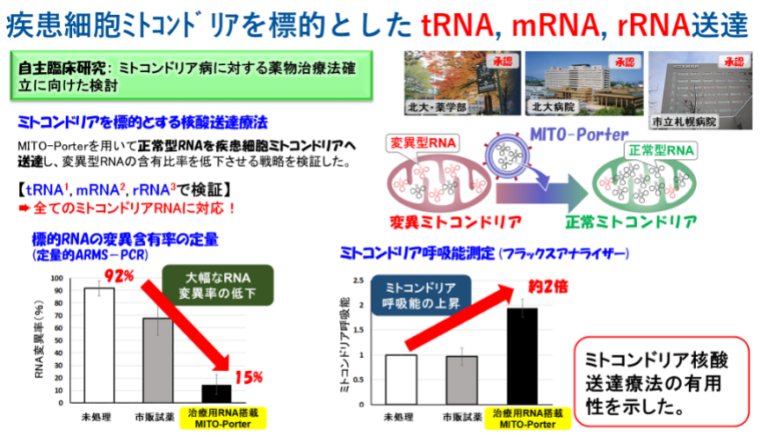
本研究では、mtDNAのtRNAPheにG625A変異を有するミトコンドリア病患者細胞を用いました。tRNAPheの変異率を低下させるために、正常型tRNAPheをMITO-Porterを用いてミトコンドリア内へ送達しました。その結果、正常型tRNAPheを投与した群ではtRNAPhe変異率の低下が認められ、さらにミトコンドリア機能の回復が観察されました。本研究は2014年より着手した自主臨床研究「ミトコンドリア病に対する薬物治療法確立に向けた検討」において、北海道大学薬学部、北海道大学病院、市立札幌病院の3施設で連携し進めた研究成果です。これまでにmtDNAがコードする全てのRNA種 (tRNA、mRNA、rRNA)に本戦略が適用可能である事を報告しています(Yamada Y. et al, Expert Opin. Biol. Ther. 2022; 11: 1-11)。現在も国内外9施設の臨床医との共同研究を推進中であり、2023年度より「ミトコンドリア遺伝子治療を実現するゲノム編集技術の創出」に関する研究(科研費・基盤研究A)にも着手しています。
ミトコンドリアを標的とする治療抵抗性癌に対する治療戦略の検証
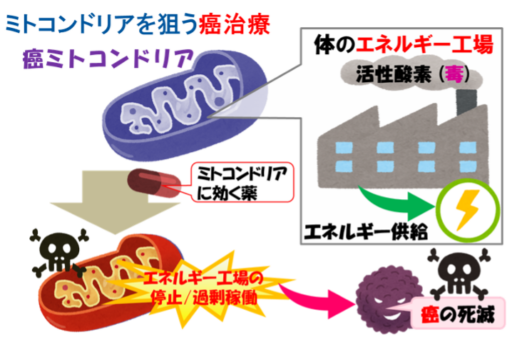
既存の抗癌剤の多くは細胞核のゲノムに作用し癌細胞を死滅させますが、これらの抗癌剤に対する治療抵抗性の獲得は、癌治療のボトルネックとなっています。私たちは、癌細胞のエネルギー工場であるミトコンドリアを破壊する治療抵抗性癌に対する新たな治療戦略の検証を進めてきました。ミトコンドリアは,細胞のエネルギー工場ですので,癌細胞のミトコンドリアを破壊すれば,癌の活動はストップします【エネルギー工場の停止】。また,エネルギー工場であるミトコンドリアでは,細胞の毒にもなる活性酸素(工場の煙)が排出されています。そのため,活性酸素を増加させるような薬をミトコンドリアに運んで癌細胞を破壊する作戦もあります【エネルギー工場の過剰稼働】。『ミトコンドリアを狙い撃ちする癌治療』は,これまでの抗癌剤とは効き方が違うので,新しい治療の選択肢を提供する事ができると期待しています。これまでの研究実績としては、薬剤性耐性癌細胞であるOSRC2細胞を用いた検討を行い、抗癌剤搭載MITO-Porterを投与した際に、ミトコンドリア機能の低下(膜電位、ATP産生)、殺細胞効果、担癌モデル動物を用いた抗腫瘍効果も観察しており、本戦略が治療抵抗性癌に対する有効な治療法になり得る事を報告しています(Yamada Y. et al, J. Pharm. Sci. 2020; 109: 2493-2500)。本研究に対して2022年に米国薬剤師会よりEbert Prize Award (米国で現存する最古の薬学賞, 日本人4例目)が授与され、国際的にも高い評価を受けています(https://www.hokudai.ac.jp/news/pdf/211209_pr2.pdf)。
癌細胞ミトコンドリアを標的とした治療抵抗性癌に対する「光治療」の検証にも着手しています。癌光治療は、患部切除を行わずに選択部位の癌組織を死滅させるため、患者の身体的負担が少ない治療法として期待されています。癌細胞 (in vitro)を用いた光治療の実績を有しており (既存薬の1/10の投与量で有意な治療効果) (Satrialdi et al, ChemCommun. 2020; 56: 1145-1148)、担癌モデル動物を用いた癌光治療の検証 (in vivo)においても良好な成果を得ております (Satrialdi et al, Nanoscale Advances 2021; 3: 5919-5927)。北海道大学病院・臨床研究開発センターの協力の基、GMP製剤の準備・CROを活用した非臨床研究の計画を立案中です (有効性・安全性データの取得)。これらの研究を推進するための研究資金調達のため、社会への情報発信も兼ねるクラウドファンディング活動 (2020年)に参画しました (北海道大学2例目)(https://readyfor.jp/projects/MITO-Porter)。 「研究活動」とは全く異なる挑戦に大いに苦戦しましたが、当初目標額を大幅に上回る10,119,000円のご支援を頂きました。「資金調達」以外にも、患者・家族との交流、学生・市民への情報発信が実現できました。本研究に対して2023年に日本薬剤学会より旭化成創剤開発技術賞が授与され、製剤・創剤開発の観点で高い評価を受けています。

本研究で採用する「ミトコンドリアを狙い撃ちする癌治療戦略」は既存薬の抗癌作用機序と異なり,薬剤耐性癌の治療にも有用であると期待されます。また,癌細胞にピンポイントに抗癌剤を運ぶナノカプセルは正常細胞への侵襲性を抑えることが期待されるため,「効果がでているのに副作用で治療を断念」などの問題点の解決にもつながる可能性があります。さらに,多彩な機能を有するミトコンドリアを標的とした創薬開発の医療用ナノカプセルの基盤技術としても貢献できると期待されます。
細胞治療を加速するDDS技術の開発
心不全は生活習慣病の増加や高齢化などに伴い,増加の一途を辿っています。また,心不全治療は薬物療法のめざましい発展などもあり治療法の幅は広がってきていますが,根本的かつ有効な治療法は確立されていません。重篤な心不全に対しては心臓移植などの外科的加療が選択されますが,適応疾患やドナーの不足などの問題点があり,日本では進んでいないのが現状です。その中でも,心不全に対して,幹細胞移植が検討されるようになり,虚血性心疾患,拡張型心筋症,先天性心疾患などの心不全に対する有望な治療法として臨床試験が多数行われています。その一方で,細胞移植療法は,持続的な移植効果維持が困難とされており,その原因として移植細胞が荒廃した心不全環境(酸化ストレスの過剰発生,エネルギー産生能の低下など)に適応が不十分であることが挙げられます。
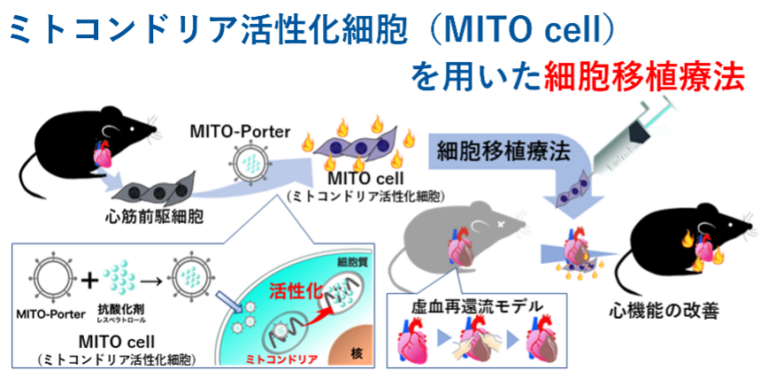
私たちは,酸化ストレス発生源でありエネルギー産生を担うミトコンドリアを活性化した移植細胞 (MITO cell)の製造を試みております。MITO cellは,ミトコンドリア型ナノカプセル(MITO-Porter)を用いて心筋前駆細胞(CPC: Cardiac Progenitor Cells)のミトコンドリアに機能性分子を送達し製造します (Abe J. et al, J. Control. Release 2018; 269: 177-188)。心筋虚血再灌流モデルマウスを作成しMITO cellを用いた細胞移植の治療効果を評価した結果,MITO cell移植群において,ミトコンドリア機能の亢進,心機能の改善,心筋組織の線維化を抑制する治療効果が観察できました (Sasaki D. et al, Sci. Rep. 2022; 12: 4344)。これらの治療効果は,従来の細胞移植療法の効果を大幅に上回るものです。
現在,私たちはヒトの心臓から単離した細胞を用いて,ヒト由来のMITO cellを作成し,細胞移植治療を行う臨床研究を開始しています。ミトコンドリアDDS技術を応用することで細胞移植療法の発展と治療が困難な心不全への治療方法が現実になると確信しています。さらに,MITO cellの適応臓器・疾患を拡張することで,細胞移植療法の臨床応用を飛躍的に加速させることが期待されます。本研究は、北海道大学病院・小児循環器班に所属する医師との連携により得た成果であり、現在も当研究室にて精力的に研究を継続中です。
