概要
私たちの研究室では、生命を「見る・診る」「操る」の二つを大きなテーマに据えて、日々研究を行っています。「見る・診る」では、生体内の特定の分子を可視化する分子イメージングにより、病気の原因の解明や病気の早期発見・早期治療法の開発に取り組んでいます。「操る」では、体内の特定の部位で活性化する薬剤を開発するとともに、生体内で化合物を自在に制御・活性化する方法の確立を目指しています。
生命を「見る・診る」または「操る」ために用いる手段は主に、「核医学」と「光」の二つです。「核医学」では、陽電子放出断層撮影 (Positron Emission Tomography; PET) に用いられる18Fや、α線放出核種の211At、191Ptなどのオージェ電子放出核種などを取り扱っています。一方、「光」は、生命科学において既に広く使われている可視光-近赤外光領域の蛍光だけでなく、より波長の短い光であるX線や、光を吸収した分子によって放出される熱を利用した光音響も用いた研究を行っています。
このように、核医学ならびに光を用いて生命を「見る・診る」「操る」ことで、病態解明や新たな診断法や治療法の開発などを目指しています。
見る・診る
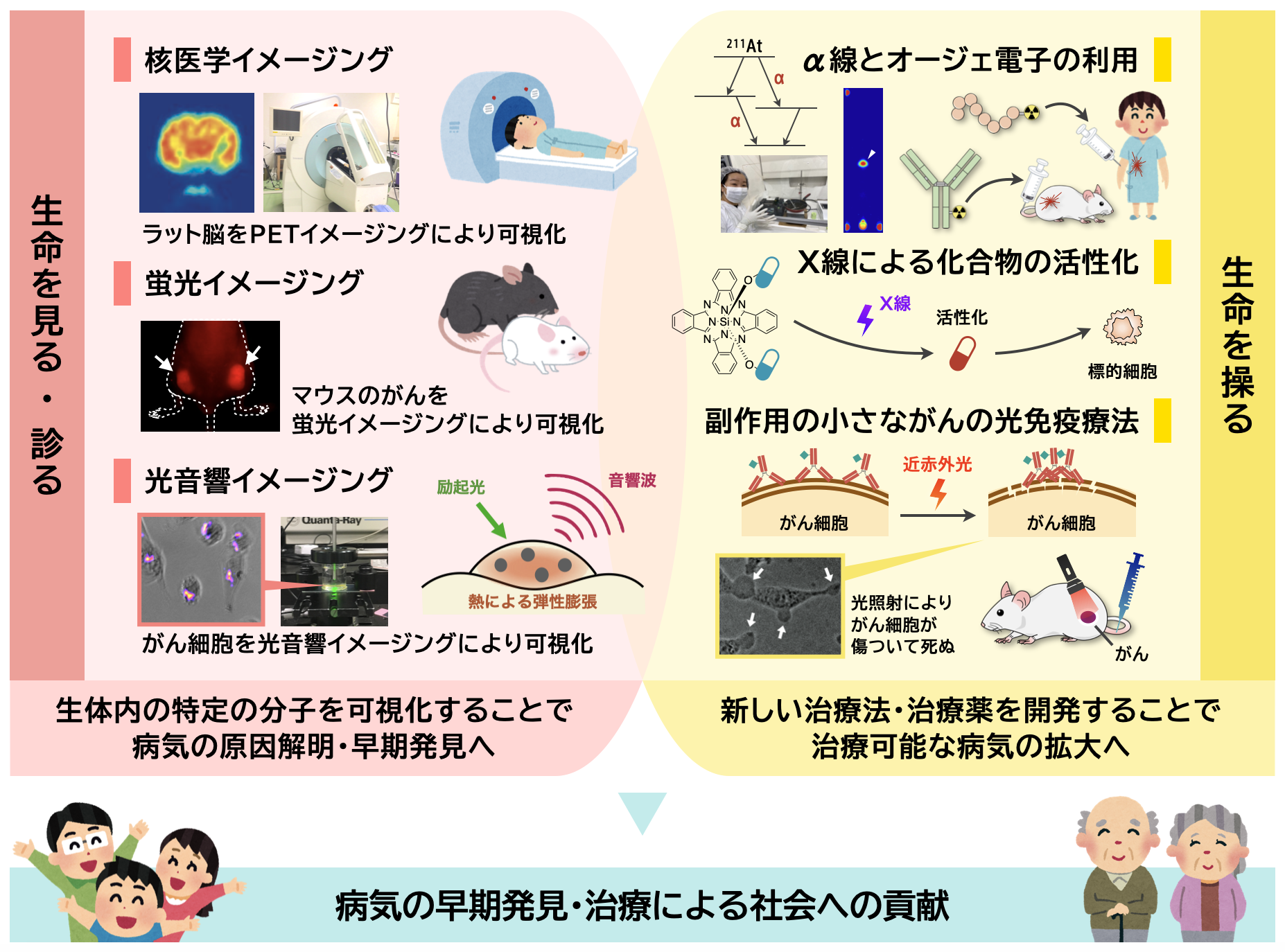
核医学イメージング
核医学イメージング (Nuclear medicine) は、陽電子放出核種である18Fなどを用いて、生体内の特定の分子を可視化する手法です。例えば、正常細胞と比較してがん細胞はグルコースを多く代謝するという性質を利用し、グルコースを18Fで標識したPETイメージング剤 ([18F]FDG) が臨床でも用いられています。核医学イメージングは、定量性が高いことや、全身検索が可能であることが利点であり、病気の早期発見や治療効果の判定に有用であると考えられています。
当研究室では、がんや炎症性疾患のモデル動物を用い、治療による生体内の変化などを核医学イメージングで解析する研究や、核医学イメージングを用いた治療効果の判定法の確立を目指した研究に取り組んでいます。
代表的な業績
- . PD1 blockade alters cell-cycle distribution and affects 3'-deoxy-3'-[18F]fluorothymidine uptake in a mouse CT26 tumor model. Ann Nucl Med 2022. Online ahead of print. PMID 35969311
- . Reduction of tumor hypoxia by anti-PD-1 therapy assessed using pimonidazole and [18F]FMISO. Nucl Med Biol 2022, 108-109, 85-92. PMID 35367730
- . Uptake of nicotinic acetylcholine receptor imaging agent is reduced in the pro-inflammatory macrophage. Nucl Med Biol 2021, 102-103, 45-55. PMID 34619460
- . Influence on [18F]FDG uptake by cancer cells after anti PD-1 therapy in an enforced-immune activated mouse tumor. EJNMMI Res 2020, 10 (1), 24. PMID 32189078
- . Anti PD-1 treatment increases [18F]FDG uptake by cancer cells in a mouse B16F10 melanoma model. EJNMMI Research 2018, 8, 82. PMID 30117062
関連する研究費
- 科学研究費助成事業 基盤研究(B) 「エネルギー代謝に着目した核医学イメージングによるがん微小環境評価」(代表:小川美香子)
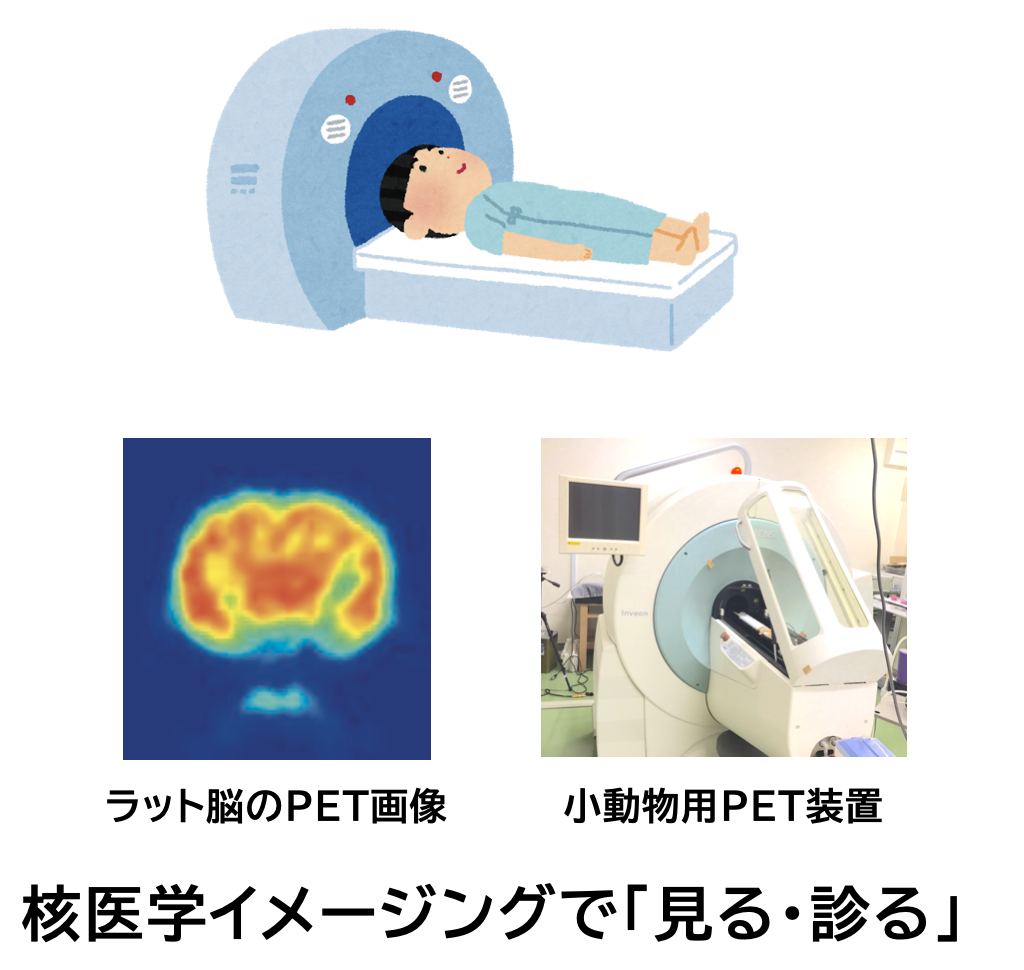
蛍光・光音響イメージング
蛍光イメージング (Fluorescence imaging) は、光を吸収した後に蛍光を発する分子を用い、蛍光分子を標識した薬剤の体内動態を解析したり、生命機能の解明などに用いられます。また、当研究室では光を利用したイメージング法として、光を吸収した分子から放出される音響波を検出する画像化法である光音響イメージング (Photoacoustic imaging)の研究にも取り組んでいます。音響波は、光と比べて生体組織に吸収・散乱されにくいため、比較的深部の組織をイメージングすることができます。
当研究室では、薬剤の動態解析などに蛍光イメージングを取り入れている他、病気の診断にも用いることができるような新たな蛍光イメージング剤の開発にも取り組んでいます。光音響イメージングでは、標的部位でのみシグナルを変化させることで高いコントラストで病変を可視化できるような光音響イメージング剤の開発に取り組んでいます。
代表的な業績
- . Correction: Takakura et al. In Vitro and In Vivo Cell Uptake of a Cell-Penetrating Peptide Conjugated with Fluorescent Dyes Having Different Chemical Properties. Cancers 2021, 13, 2245. Cancers (Basel) 2022, 14 (8), 1880. PMID 35454954 (Correction to PMID 34067065)
操る
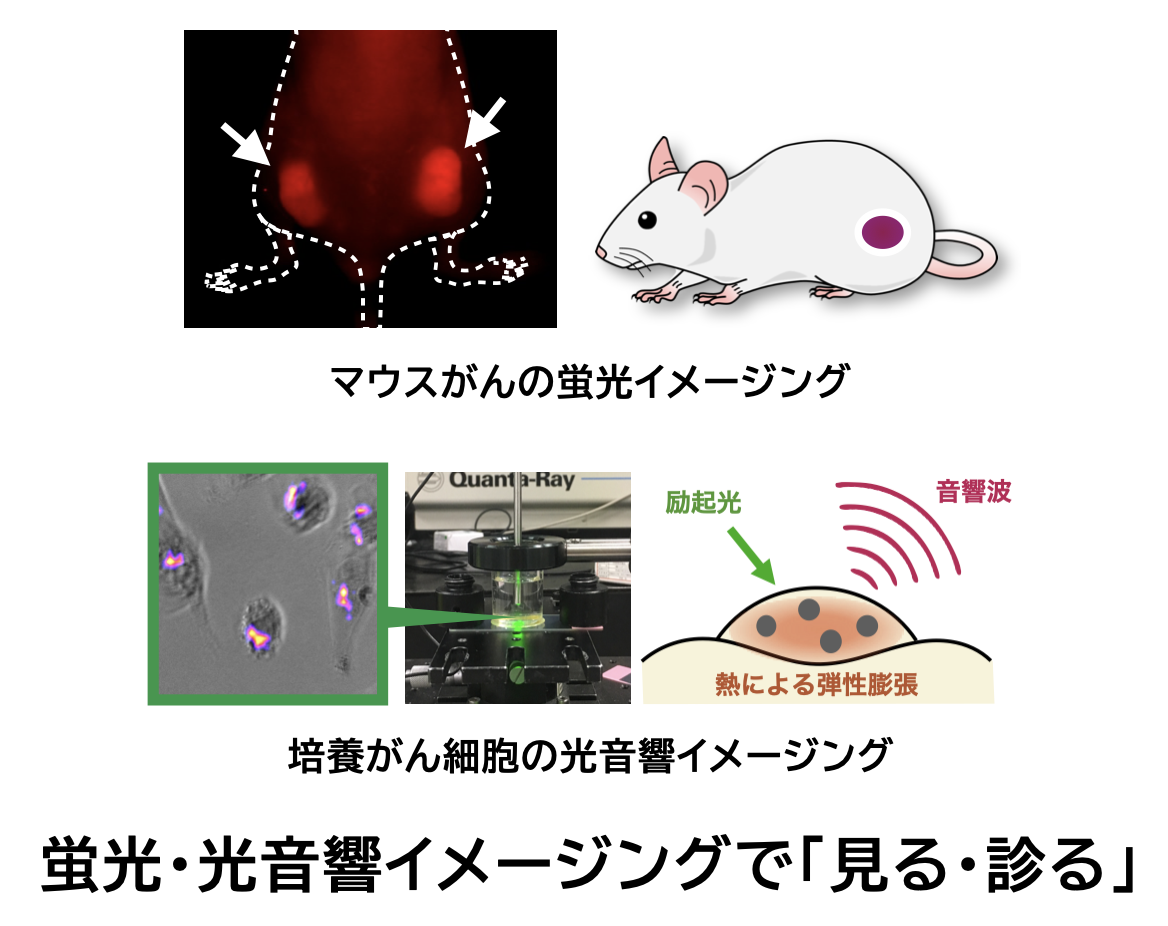
α線とオージェ電子の利用
がんの治療において、β線を放出する放射性同位体が古くから用いられてきました。一方、これまで放射線治療に利用されてきたβ線と比較して、飛程が短いα線やオージェ電子が、近年注目されています。生体内でのα線の飛程は細胞数個分、オージェ電子の飛程は分子数個分であることから、照射範囲が極めて狭く、標的とする分子や細胞だけを特異的に殺傷できると期待されています。
当研究室では、α線放出核種やオージェ電子放出核種の安定的に標識する方法の確立や、標識薬剤によるがんの治療効果に関する検討を行っています。特に、α線を放出する211Atや、オージェ電子を放出する191Ptなどを用いて、α線とオージェ電子の適用可能性を探っています。
代表的な業績
- . Development of novel 191Pt-labeled Hoechst33258: 191Pt is more suitable than 111In for targeting DNA. J Med Chem 2022, 65 (7), 5690-5700. PMID 35358392
- . Transition-metal-free nucleophilic 211At-astatination of spirocyclic aryliodonium ylides. Org Biomol Chem 2021, 19 (25), 5525-5528. PMID 34124736
- . In Vitro Evaluation of No-carrier-added Radiolabeled Cisplatin ([189, 191Pt]cisplatin) Emitting Auger Electrons. Int J Mol Sci 2021, 22, 4622. PMID 33924843
- . Synthesis of no-carrier-added [188, 189, 191Pt]cisplatin from a cyclotron produced 188, 189, 191PtCl42-) complex. Sci Rep 2021, 11, 8140. PMID 33854142
関連する研究費
- AMED医療機器等研究成果展開事業「固相法によるアスタチン標識化合物自動合成装置の開発」(代表:小川美香子)
X線による化合物の活性化
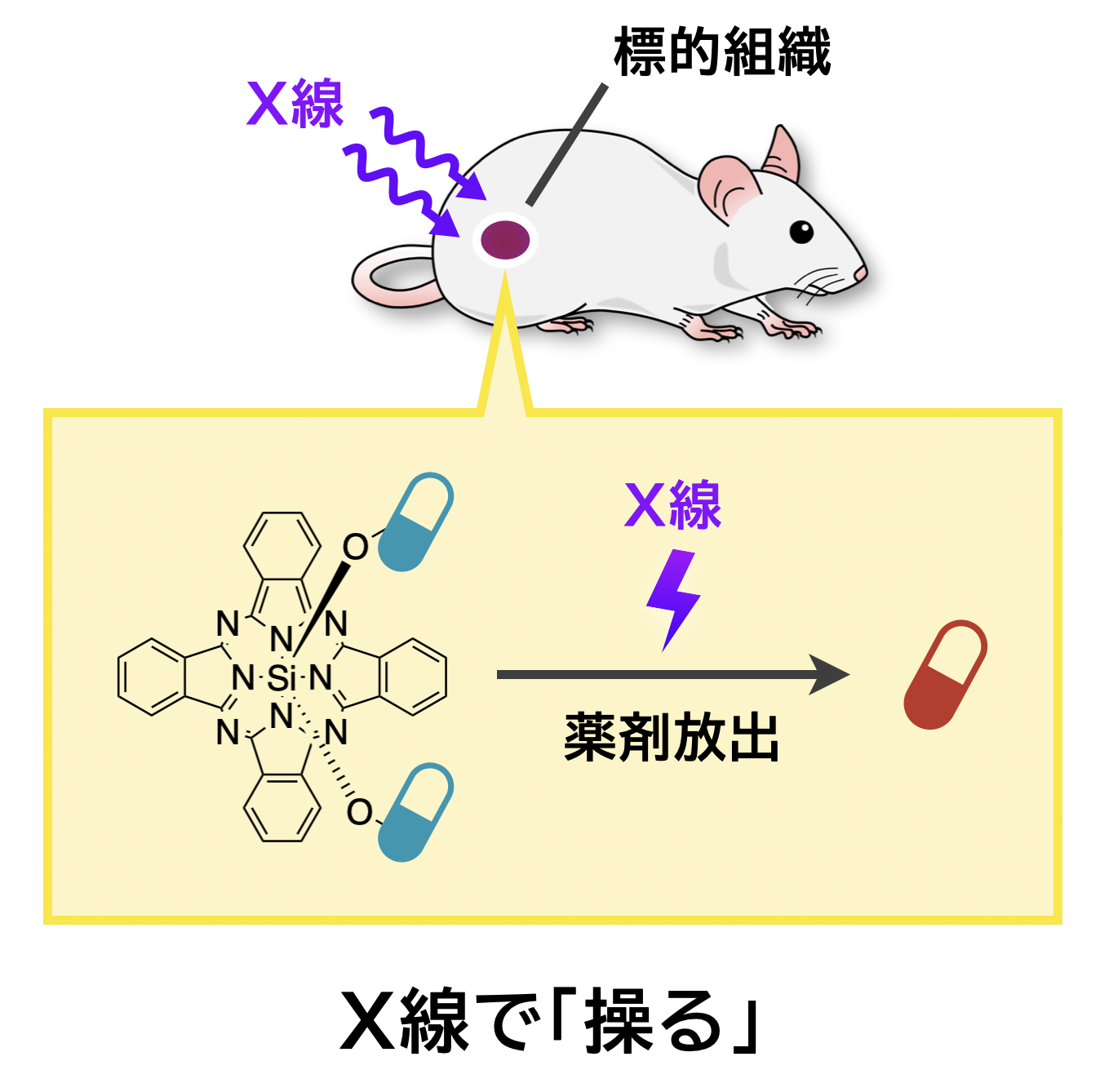
ケージド化合物は、光などの外部刺激を加えることで生理活性物質などを放出する化合物であり、狙った部位だけで生体機能を制御することが可能です。現在のところ、ケージド化合物の活性化には、エネルギーの観点から主に紫外-可視光が用いられます。しかし、紫外-可視光は生体透過性が低い電磁波であり、生体での適用はマウス脳のごく表層などに限られ、ヒトへの応用は達成されていません。
そこで当研究室では、ケージド化合物を生体で利用するための外部刺激として、生体深部まで届くことのできるX線に着目しています。現在、X線照射によって脱離する化学構造の探索を行うとともに、生体においてX線を照射した部位でのみ活性化する化合物の開発に取り組んでいます。これにより、正常組織への副作用を抑えて病変部位の治療を行うことが可能になると期待しています。
代表的な業績
- . Ligand release from silicon phthalocyanine dyes triggered by X-ray irradiation. Org Biomol Chem 2022. Online ahead of print. PMID 35972402
- . Axial-ligand-cleavable silicon phthalocyanines triggered by near-infrared light toward design of photosensitizers for photoimmunotherapy. J Photochem Photobiol A: Chem 2022, 426 (1), 113749. DOI 10.1016/j.jphotochem.2021.113749
関連する研究費
- JST CREST[革新光]「光を用いたヒト生体深部での分子制御」(代表:小川美香子)
光免疫療法 (PIT)
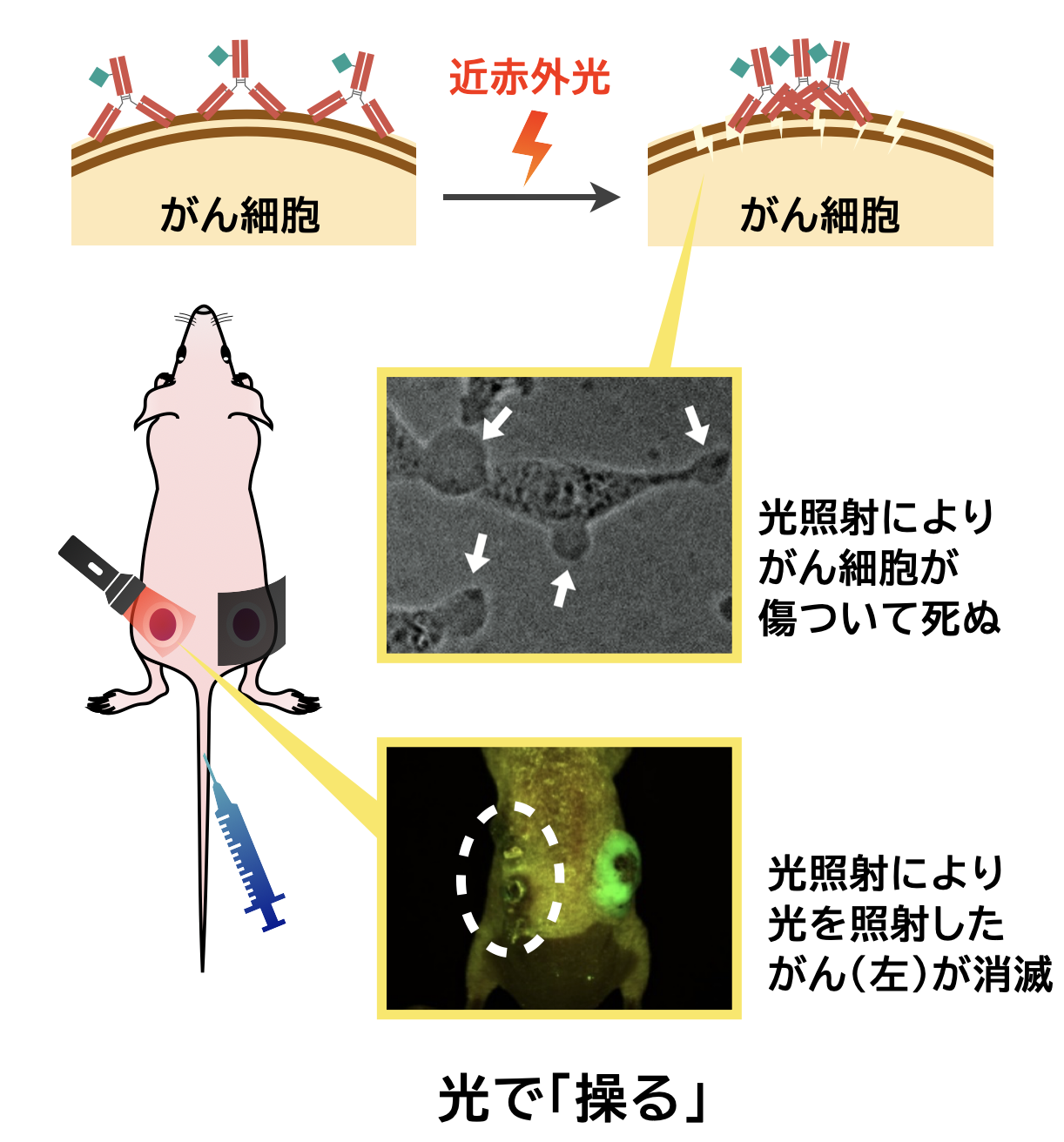
光免疫療法 (Near-infrared photoimmunotherapy; PIT) は、近赤外光に反応する薬剤を用い、がんに近赤外光を照射することによってがん細胞だけを特異的に殺傷する新たながん治療法です。がん細胞周囲に存在する正常細胞を傷つけないことや、宿主の免疫を活性化することを特徴とし、治療効果も高いことから注目を集めています。しかし、細胞傷害のメカニズムが完全には解明されていないため、より治療効果と汎用性の高い新薬の開発が難しくなっています。
そこで当研究室では、様々な手法を用いてPITのメカニズムの解明を行っています。例えばこれまでに、光反応性薬剤が、光照射によって凝集体となることでがん細胞の細胞膜を物理的に破壊することを発見しました。また、弱い光であっても効率的に反応することができ、治療効果がより高い新たな薬剤の開発にも取り組んでいます。
代表的な業績
- . EPR Characterisation of Phthalocyanine Radical Anions in Near-Infrared Photocleavage of the Hydrophilic Axial Ligand of a Photoimmunotherapeutic Reagent, IR700. ChemPhotoChem 2022, 6 (1), e202100172. DOI 10.1002/cptc.202100172 (Cover Profile:DOI 10.1002/cptc.202100277)
- . Comparison of low-molecular-weight ligand and whole antibody in prostate-specific membrane antigen targeted near-infrared photoimmunotherapy. Int J Pharm 2021, 609, 121135. *Contributed equally. PMID 34571072
- . Analysis of the triplet-state kinetics of a photosensitizer for photoimmunotherapy by fluorescence correlation spectroscopy. J Photochem Photobiol A: Chem 2021, 408, 113094.
- . Theoretical and Experimental Studies on the Near-Infrared Photoreaction Mechanism of a Silicon Phthalocyanine Photoimmunotherapy Dye: Photoinduced Hydrolysis by Radical Anion Generation. Chempluschem 2020, 85, 1-6. PMID 32449613 (Cover Profile:PMID 32830450)
- . Changes in plasma membrane damage inducing cell death after treatment with near-infrared photoimmunotherapy. Cancer Sci 2018, 109 (9), 2889-2896. PMID 29949672
関連する研究費
- JSTさきがけ[光極限]「光と生体の新たな相互作用を利用したがん治療法の開発」(代表:小川美香子)