北海道大学大学院 薬学研究院 衛生化学研究室
〒060-0812 北海道札幌市北区北12条西6丁目
tel.011-706-3243 fax.011-706-4990
研究概要Research
1. インターロイキン6(IL-6)のシグナル伝達分子STAT3活性化制御機構の解明
Study 1: Controlling mechanism of a signaling molecule, STAT3 activation by interleukin (IL)-6
IL-6はB細胞に作用して抗体産生を誘導するT細胞由来のサイトカイン、B細胞刺激因子(BSF-2/IL-6)としてcDNAクローニングされた多機能サイトカインです。興味深いことに、IL-6は自己免疫疾患である関節リウマチや、キャッスルマン氏病、あるいは多発性骨髄腫などの癌の発症に重要な役割を果たしていることが明らかにされました。さらに、IL-6は免疫系細胞のみならず、乳癌、前立腺癌を始めとする種々の癌細胞の増殖分化にも深く関わっていることが報告されています。
一方、IL-6を中心とするIL-6ファミリーサイトカインの作用は主にシグナル伝達分子であるSTAT3によるものであることが明らかにされています。STAT3の活性化は種々のがん細胞増殖にも重要とされており、実際、多発性骨髄腫や乳がん等のがん細胞において恒常的なSTAT3の活性化が報告されており、STAT3自身がオンコプロテインとして注目されています。また、自然免疫、炎症応答を担うTLRシグナルやNF-κBの活性化をSTAT3が調節することが報告され、自然免疫の制御因子としても注目されています。
さらに近年の大きなトピックとして関節炎や腸炎等の疾患発症に関与する新たな疾患関連ヘルパーT細胞集団として発見されたTh17の分化にIL-6/STAT3シグナルが重要であることが明らかにされ、IL-6が関与する種々の疾患の病態解明が、大きく前進しました。また、自己免疫疾患であるクローン病やウェゲナー肉芽腫症、サルコイドーシスなど難病/特定疾患は病的肉芽腫を特徴とすることが知られていますが、わたしたちは実験的肉芽腫形成反応においては、IL-6やSTAT3、Th17細胞が重要な働きをすることも明らかにしました。IL-6/STAT3/Th17シグナルの同定により関節リウマチ治療薬トシリズマブ(抗IL-6レセプター抗体)による疾患治療効果のメカニズムの詳細が明らかになるに伴い、新たなIL-6/STAT3シグナル阻害剤開発への期待と夢も大きくなりつつあります。
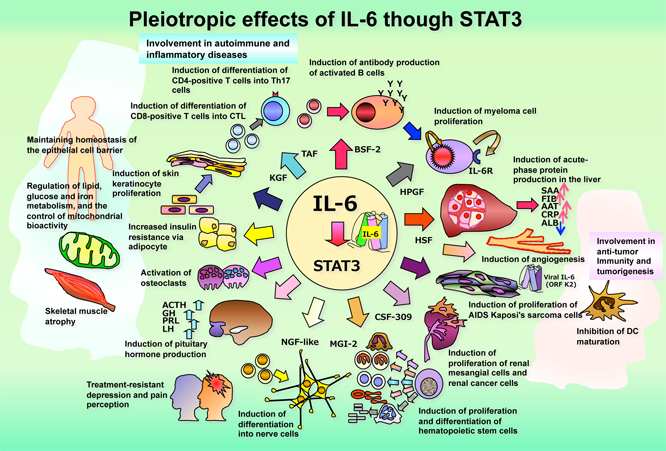
さらに、ヒトにおいて重症のアトピー性皮膚炎、皮膚膿症、肺炎を伴う高IgE症候群の原因遺伝子としてSTAT3が同定され、STAT3のDNA結合領域の遺伝子変異によってこれらの病気が起こることが明らかにされています。これら疾患に対する新しい治療法開発への突破口となることも期待されています。また、ヒトにおいてIL-6によりSTAT3を活性化するgp130受容体の異常は冠状動脈硬化症や心筋梗塞と関連することが証明されており、これらのシグナル異常は生活習慣病の発症とも深く関連していると考えられ、IL-6/STAT3シグナルは『疾患関連サイトカインシグナル』として世界の注目を浴びています。図にはIL-6/STAT3シグナル伝達系の多彩な生物学的機能と実験的肉芽腫形成モデルでのIL-6シグナルの働きを示しています。
Interleukin (IL)-6 is a pleiotropic cytokine that has first been cDNA cloned as a B cell stimulating factor (BSF-2/IL-6), a T cell derived cytokine that induces antibody production by stimulated B cells. Interestingly, IL-6 plays a crucial role in the development of autoimmune diseases such as rheumatoid arthritis, Castleman’s disease, as well as cancers such as multiple myeloma. The involvement of IL-6 is not limited to cells of the immune system, but is also involved in the proliferation and differentiation of various cancer cells, including breast and prostate cancers. The effects of IL-6 cytokine family members, especially IL-6, are mediated by the signaling molecule STAT3. Activation of STAT3 is also crucial for the proliferation of various cancer cells, and constitutive activation of STAT3 has been observed in multiple myeloma and breast cancer, indicating STAT3 is an oncoprotein. It was reported that STAT3 is also shown to regulate activation of toll-like receptor (TLR) signaling and nuclear factor-κB, which are responsible for innate immunity and inflammatory responses, and is gaining increased attention as a controlling factor of innate immunity. Recently, the importance of IL-6/STAT signaling for the differentiation of T helper (Th)17 cells, a newly discovered group of disease-related Th cells associated with the development of arthritis and enteritis, has been shown. This finding has helped advance the analysis of various IL-6-related disease conditions. With regard to intractable diseases including autoimmune diseases such as Crohn’s disease, Wegener's granulomatosis, and sarcoidosis that are characterized by pathogenic granuloma, we demonstrated that IL-6, STAT3, and Th17 cells had a crucial role in the experimental response to granuloma formation. Since the detailed mechanism of action for Tocilizumab (Actemura®, anti-IL-6 receptor antibodies), used for the treatment of rheumatoid arthritis, was revealed following identification of IL-6/STAT3/Th17 signaling, the development of a novel IL-6/STAT3 signaling inhibitor has become a target for drug development. Moreover, STAT3 was found to be the causal gene for severe atopic dermatitis, skin abscesses, and hyper IgE syndrome with pneumonia in humans, and these medical conditions are found to develop when the STAT3 DNA binding domain is mutated. This finding is expected to be a breakthrough for the development of a new treatment for these diseases. It was also demonstrated that abnormalities of gp130 receptor proteins that activate STAT3 by IL-6 in humans are associated with coronary sclerosis and myocardial infarction. It is considered that abnormalities of signaling are strongly associated with the development of lifestyle-related diseases as well. Taken together, IL-6/STAT3 signaling is gaining attention worldwide as “disease-related cytokine signaling.” Figure 2 shows the pleiotropic biological functions of IL-6/STAT3 signaling pathways and the effects of IL-6 signaling in an experimental model of granuloma formation.
2. アダプター分子STAP-2による免疫系シグナル伝達の調節機構の解明
Study 2: Mechanism of signal regulation in the immune system by an adaptor protein, Signal-Transducing Adaptor Protein-2 (STAP-2)
細胞内シグナル伝達経路においてキナーゼや転写因子などの活性はアダプター蛋白群により非常に緻密に制御されています。 アダプター蛋白群にはSH2ドメインやPTBドメインなどリン酸化チロシン残基を認識するドメインやプロリンに富む配列を持つ蛋白と結合するSH3ドメイン、さらにリン脂質結合モチーフとして膜結合性を示すPHドメインなどを有しています。
アダプター蛋白はこれら機能ドメインを介して様々な酵素の活性を制御するばかりでなく、アダプター蛋白同士の相互作用によってもシグナル伝達系を調節しています。 一方、これらアダプター蛋白の機能異常も免疫疾患や細胞のがん化をはじめとする様々な疾患の発症に深く関係しており、アダプター蛋白の機能の詳細な解明は疾患発症の分子メカニズムをひも解く鍵となり得ます。
2003年にSignal-Transducing Adaptor Protein-2(STAP-2)がクローニングされ、細胞内シグナル伝達経路における新たなアダプター分子として現在注目されています。STAP-2は、胎性肝cDNAライブラリーを用いた酵母two-hybrid法により、c-fms結合分子として同定されたアダプター蛋白で、乳癌特異的チロシンキナーゼBrk(Breast tumor kinase)の基質であるBKS(Substrate of Brk)のマウスホモローグです。マウスSTAP-2は411アミノ酸、ヒトSTAP-2では403アミノ酸により構成されており、N末端側からPHドメイン(リン脂質結合性を示す)、 SH2様ドメイン(リン酸化チロシン残基との結合に関与する)、C末端側にプロリンに富むドメイン(SH3ドメインを有する蛋白との結合に関与する)を有しています。以前にクローニングされたもうひとつのSTAPアダプターファミリー蛋白であるSTAP-1が造血系特異的な発現を示すのに対し、STAP-2の発現は多くの組織において認められる点から、STAP-2の種々の組織・細胞系列でのシグナル伝達系への関与が考えられます。
STAP-2は、B細胞分化因子であるIL-6のシグナル伝達分子であるSTAT3の転写活性を正に調節することで、IL-6による肝細胞での急性期応答炎反応の促進・維持に関与していることが明らかとなっています。また、IL-2やエリスロポイエチン造血系、免疫系の維持に重要なシグナル伝達分子STAT5の活性を負に調節します。 特に、免疫反応に重要な胸腺細胞のIL-2依存的な増殖を調節することも分かりました。さらに、ラット由来の好塩基球細胞を用いた研究から、IgEレセプターのシグナル伝達、いわゆるアレルギー反応をSTAP-2が負に制御することが示されており、アレルギー反応にも関与していることが示唆されています。
これまで抗体産生に関与するIL-6やT細胞増殖分化に作用するIL-2の機能調節等、獲得免疫とよばれる免疫応答でのSTAP-2の役割をこれまでに明らかにしてきましたが、最近、自然免疫(感染初期に誘導される免疫反応)にも関与していることが明らかとなっております。自然免疫系において、種々の外来微生物由来の特異的な物質は、TLRを介して認識されシグナルを伝達し、炎症性サイトカイン等を産生することで免疫系細胞を活性化します。細菌細胞壁成分であるリポ多糖を認識するTLR4からのシグナル伝達経路において、STAP-2が下流のシグナル伝達分子と相互作用し、TLR4シグナルを増強させることが明らかとなりました。すなわちSTAP-2は獲得免疫に関与するだけでなく、自然免疫においても機能し、わたしたちの身体の生体防御機構において重要な役割を果たしています。
免疫系細胞、特にT細胞における細胞接着や細胞遊走反応は炎症の演出やリンパ系組織の構築において重要な役割を担っています。興味深いことに、このT細胞における接着・遊走反応にもSTAP-2が関与していることが明らかとなってきました。また、T細胞の過剰な活性化はアレルギーや自己免疫疾患発症の原因ともなりますが、そのためT細胞では活性化細胞死AICD(activation-induced cell death)と呼ばれる恒常性維持機構が存在します。T細胞内のSTAP-2はこのAICDを調節することもわかってきました。すなわち、STAP-2が種々の免疫疾患の発症に関与し、免疫疾患治療薬の標的となりうる可能性が考えられています。
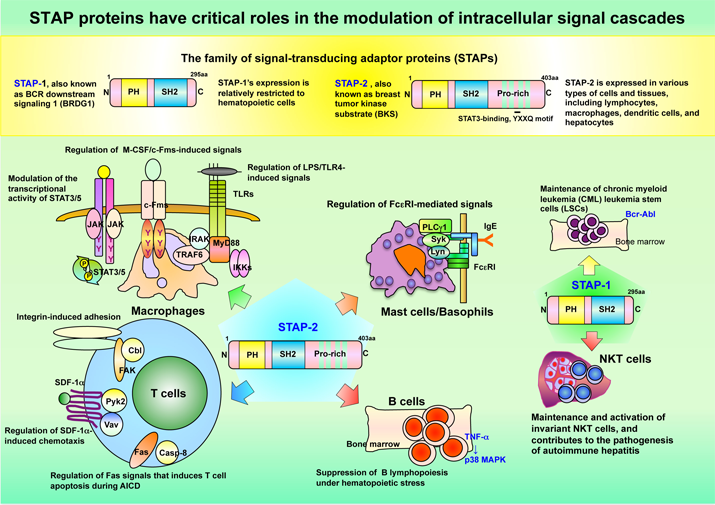
一方で、STAP-2はEpstein-Barrウイルス産物であるLMP1 と相互作用し、その機能発現を調節することもわかりました。さらにSTAP-2が乳がん細胞や慢性骨髄性白血病細胞の増殖調節に関与することも明らかになっています。 わたしたちは、今後、自然免疫から獲得免疫をリンクする新規アダプター分子STAP-2のより詳細な機能解析を行い、これらSTAP-2の研究が免疫疾患の病因解明だけでなく、種々のがん治療薬開発の一助となることを期待しています。図には新規アダプター分子STAP-2の免疫シグナル伝達系における多彩な生物学的機能を示しています。
Activities of kinases and transcription factors are precisely controlled by a group of adapter proteins in the intracellular signaling pathways. Adaptor proteins contain domains that recognize phosphorylated tyrosine residues, including SH2 and PTB domains, an SH3 domain that binds to proteins containing a proline-rich sequence, and a PH domain that exhibits membrane binding as phospholipid binding motifs. Adaptor proteins control activities of various enzymes via these functional domains, and regulate signaling pathways by interacting with other adapter proteins. Abnormalities in the functions of these adaptor proteins are strongly related to the development of immunological diseases, cancer, and other diseases. Therefore, clarification of detailed functions of adaptor proteins is likely to be key in revealing the molecular mechanisms of disease development.
Signal-transducing adaptor protein-2 (STAP-2), cloned in 2003, is attracting attention as a novel adaptor molecule in intracellular signaling pathways. STAP-2 is an adaptor protein identified as a c-fms binding molecule by a yeast two-hybrid system that used an embryonic liver cDNA library. It is a mouse homolog of BKS, a substrate of breast cancer-specific tyrosine kinase Brk (breast tumor kinase). Murine and human STAP-2 consists of 411 and 403 amino acids, respectively, and it has a PH domain at the N terminal that binds to phospholipids, an SH2-like domain that binds to phosphorylated tyrosine residues, and a proline-rich domain at the C terminal that binds to proteins with a SH3 domain. STAP-1, another STAP adaptor family protein that was previously cloned, shows hematopoietic system-specific expression, in contrast to STAP-2 expression that is observed in many tissues. This suggests that STAP-2 is associated with signaling pathways in various tissues and cell lines. It was demonstrated that STAP-2 promotes and maintains IL-6-induced acute-phase responses and inflammatory responses in liver cells by positively regulating the transcription activity of STAT3. It negatively regulates the activity of STAT5, an important signaling molecule for the maintenance of IL-2, erythropoietin (a hematopoietic system factor), and the immune system. Furthermore, STAP-2 regulates the IL-2-dependent proliferation of thymocytes that are important for T cell responses. A study in rat-derived basophils showed that STAP-2 negatively controls signaling from IgE receptors, suggesting the involvement of STAP-2 in allergy reactions. Thus far, roles of STAP-2 in acquired immunity immune responses have been demonstrated, including IL-6 association with antibody production and regulation of IL-2 functions related to proliferation and differentiation of T cells. More recently, it was revealed that STAP-2 is also associated with innate immunity. In innate immunity, immune cells are activated when specific substances derived from foreign microorganisms are recognized and signaling occurs via TLR, and inflammatory cytokines are produced. STAP-2 enhances TLR4 signaling by interacting with downstream signaling molecules in the TLR4 signaling pathway, which is triggered by a component of bacterial cell walls, lipopolysaccharides. Thus, STAP-2 is involved not only in acquired immunity but innate immunity, playing an important role in the biological defense mechanisms of our bodies. Adhesion and migration of immune cells, especially T cells, are important in the inflammatory process and formation of lymphatic tissues. Interestingly, association of STAP-2 in T-cell adhesion and migration has also been revealed. Excessive activation of T cells can cause allergies and autoimmune diseases, and the activation of T cells is regulated by a homeostatic mechanism called activation-induced cell death (AICD). Recent studies have shown that STAP-2 in T cells also regulates AICD, suggesting STAP-2 might be a target molecule for the treatment of immune diseases. STAP-2 also interacts with LMP1, a byproduct of the Epstein-Barr virus, and regulates its functional expression. Involvement of STAP-2 in the regulation of breast cancer cell and chronic myelogenous leukemia cell proliferation has also been demonstrated. We hope the results from our study of the detailed functions of the novel adaptor molecule STAP-2, that links innate immunity to acquired immunity, will help identify the etiology of immunological diseases and the development of anticancer agents. The Figure 3 below shows pleiotropic biological functions of the novel adaptor molecule STAP-2 in relation to immune system signaling.
- 研究概要Research
- はじめにIntroduction
- 1.インターロイキン6(IL-6)のシグナル伝達分子STAT3活性化制御機構の解析Study 1: Controlling mechanism of a signaling molecule, STAT3 by interleukin (IL)-6
- 2.アダプター分子STAP-2による免疫シグナル調節機構の解析Study 2: Mechanism of signal regulation in the immune system by an adaptor protein, Signal-Transducing Adaptor Protein-2 (STAP-2)
- 3.TYK2の新たな機能解明Study 3: Discovery of the novel functions of Tyrosine Kinase 2(TYK2).
- 4.マスト細胞/好塩基球活性化分子機構の解明および新規アレルギー治療標的分子の探索Study 4: Investigation of molecular mechanisms in mast cell/basophil activation and identification of new therapeutic candidates for allergy.
- 5.がん免疫作用機構の解明と新たな抗がん剤の開発Study 5: Study of mechanism in cancer immunity and development of new anti-cancer drugs.