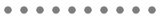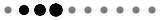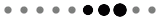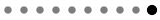-
歯学研究院 研究内容
血管グループ
血管制御による疾患治療の実現
本プロジェクトは、2009年より北大初の部局横断プロジェクトとして薬学研究院原島秀吉先生グループとの連携により開始された。第一期「血管を標的とする革新的医薬分子送達法の基盤技術の確立」(2009年度~2013年度)、第二期「血管を標的とするナノ医療の実用化」(2014年度~2018年度)に続いて、2019年4月より工学研究院の渡慶次学先生のグループが参画され「血管を標的とするナノ医療の実装~Personalized Nanomedicineの北大ブランド化~」が始まった。これまでの腫瘍血管内皮細胞の特異性に関する研究から、炎症性形質を標的とした免疫微小環境の制御における腫瘍血管の標的化を目指す研究から、がん関連血栓症の治療標的探索、さらには血栓症が特徴である新型コロナ感染症重症化における血管病態の解明と治療薬開発を目指すものへと研究の方向性が広く展開された。
この5年間の成果をまとめると、Top10%被引用論文の割合は原著論文で45%、全論文で38%という成果となった。本プロジェクトで掲げたKPIのうち①Top10%被引用論文の割合35%という目標の達成に貢献することができた。一方で②大型共同研究(年間500万円以上)2件、③産業創出講座1件は達成できなかった。しかし、この5年間で特許出願に向けて準備を進めている研究シーズも生まれたことから、今後は産学連携につなげられると考えている。本研究プロジェクトにより、多くの若手研究者がその研究成果により受賞した。人材育成の観点からも成果があり、特に女性研究者の育成にも貢献することができた。
2019年度~2023年度の成果
- 腫瘍血管炎症形質を腫瘍免疫微小環境の正常化
腫瘍血管を裏打ちする腫瘍血管内皮細胞(Tumor endothelial cell: TEC)の特異性のうち、特にその炎症形質が免疫微小環境に与える影響について研究を進めた。
我々はTECがIL-6を高発現するなど炎症性に変化していること、さらにその機序のひとつとして腫瘍から分泌される細胞外小胞に内包されるmiRNA-1246の役割を明らかにした (Torii C, et al, Sci Rep. 2021 Jul 5;11(1):13502、本学プレスリリース https://www.hokudai.ac.jp/news/2021/07/mirnail-6mirna-1246.html)。近年、抗がん剤治療により炎症が誘導されることが知られるようになってきたが、我々はゲムシタビン・シスプラチン治療後の組織において誘導される炎症性サイトカインIL-8がTECの薬剤排出トランスポーターMDR1/ABCB1の発現を亢進させること、TECのABCB1標的が抗がん剤耐性克服につながり新しい戦略である可能性を示唆した(Kikuchi H, et al, Cancer Res. 2020 Jul 15;80(14):2996-3008、 本学プレスリリース https://www.hokudai.ac.jp/news/2020/06/post-684.html)。
正常内皮細胞(NEC)に比べTECで発現亢進していた遺伝子(TECマーカー)のうち、 DAMPsの一つであるBiglycan (Bgn)についても、新たな機能について明らかにした。これまで我々はBgnがTECの血管新生能促進に働くのみならず、腫瘍細胞の浸潤転移能を亢進させることを報告してきた。今期はノックアウトマウスの詳細な解析により、Bgn阻害が腫瘍の線維化抑制し、CD8陽性T細胞の腫瘍内浸潤を増加させ、乳がんの抗がん剤治療効果を高めることを示した(Li C, et al, Breast Cancer Research 2021 May 10;23(1):51, 被引用数Top10%、本学プレスリリース https://www.hokudai.ac.jp/news/2021/05/biglycan.html)。重要なことに、我々はBgnが肺がんの診断マーカーならびに予後予測因子となる可能性も示した(Morimoto H, et al, Thoracic Cancer 2021 May;12(9):1347-1357)。さらに、 TECのBgnが、LDLの腫瘍内蓄積と好中球集積、活性化によるNET形成を促進し、腫瘍の転移を誘導することを示した。その機序としてTECに発現する酸化LDLの受容体LOX-1が重要な役割を担っていることを見出した(Tsumita T, et al, Int J Cancer. 2022 Sep 15;151(6):944-956, 被引用数Top10%、本学プレスリリース https://www.hokudai.ac.jp/news/2022/06/ldl.html)。
以上より、 TEC―Bgnが治療標的としても有望である可能性が示された。そこで我々は、原島グループとの共同研究で、TEC特異的リポソームsiRNAデリバリーシステムを用いて、Bgn siRNA送達によるin vivo抗腫瘍効果、血管新生阻害効果、腫瘍血管の正常化、腫瘍の線維化低下を明らかにし(Maishi N, et al, Cancer Sci. 2022 May;113(5):1855-1867、 本学プレスリリース https://www.hokudai.ac.jp/news/2022/03/biglycan-1.html)、Bgn標的とした新規血管新生阻害療法を確立した(図1)。
免疫チェックポイント阻害剤(ICI)のみでは腫瘍増殖抑制には不十分なことが多い。免疫細胞の浸潤を改善するためには、腫瘍血管を正常化する血管新生阻害剤(AI)が必要である。そこで、 我々はAIを前投与により、血管正常化が起こるタイムポイントでICI投与を投与することで免疫細胞浸潤が改善し、ICIの治療効果が高まる可能性を示した(Sato M, et al, Cancer Med. 2023 Apr;12(8):9760-9773, 被引用数Top10%、本学プレスリリース https://www.hokudai.ac.jp/news/2023/03/post-1194.html)。この結果をもとに、愛媛大学の竹田浩之先生との共同研究によりBgn阻害剤候補化合物のスクリーニングも進めた。In vivo 機能解析が終了し、原島先生との連携によるDDSによる治療への応用も視野に入れてin vivo治療効果検証の準備を進めている(図1)。
炎症を惹起させるBgnがTECから分泌され、微小環境に作用し、腫瘍の進展に働いていることが明らかになったことから、我々は原発巣に加えて転移臓器における血管炎症と転移の関係についても研究を進めた。口腔内細菌Streptococcus mutansが歯周炎などにより血中に侵入し、肺の血管に炎症性変化を起こしてがんの転移を誘導することを報告した(Yu L, et al, Cancer Sci. 2022 Nov;113(11):3980-3994、被引用数Top10%、Cancer Science Young Scientist Award、先端歯学スクール最優秀賞受賞、本学プレスリリース https://www.hokudai.ac.jp/news/2022/09/post-1097.html)。さらに我々は、がん患者の死亡原因として2番目に多い血栓症にも血管炎症が寄与することを実証した (Yu L, et al, Cancer Sci. 2024 Feb;115(2):648-659、本学プレスリリース https://www.hokudai.ac.jp/news/2023/12/post-1368.html)。
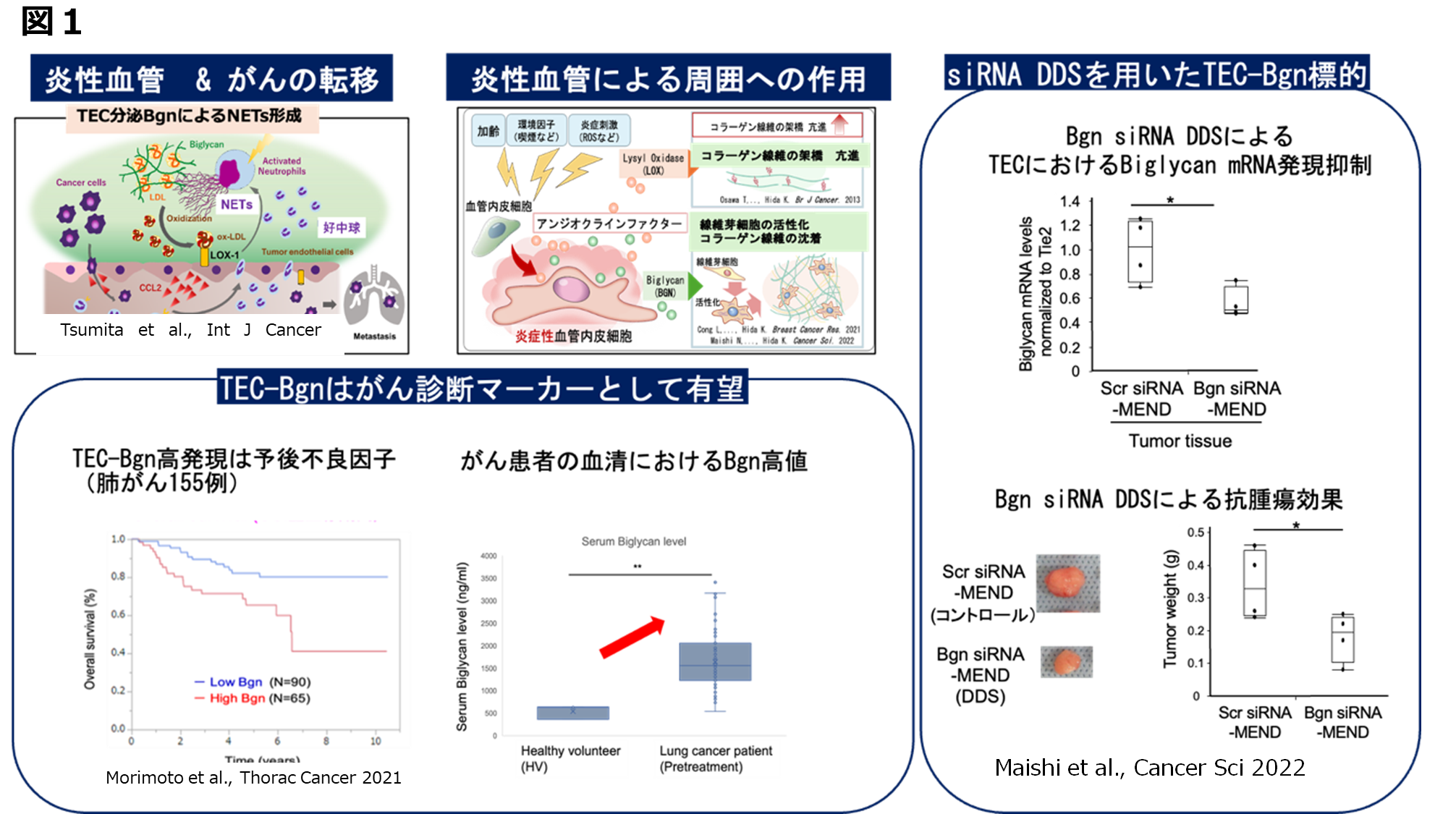
一方、我々はTECの幹細胞性の発見により、TECががん細胞とともにクラスターを形成し転移形成に深く関与するという新たな転移機構を着想し、in vivo マウスモデルならびにヒト臨床検体により実証した。トランスクリプトーム解析により、TECがクラスター中のがん細胞の生存をサポートしていることを見出した。渡慶次先生グループが開発した3Dデバイスを用いて、40例以上のがん患者血液検体を解析し、がん患者血中クラスター捕捉に成功した。また、200例以上の早期がん患者の病理組織標本を解析し、本クラスターの検出が再発転移と高い相関を示すことを明らかにした(論文投稿準備中)。転移予測、あるいは術後抗がん剤治療の必要性判定に応用可能な新たな診断方法開発を目指している(図2)。
- 感染症における血管病態の解明と治療薬開発
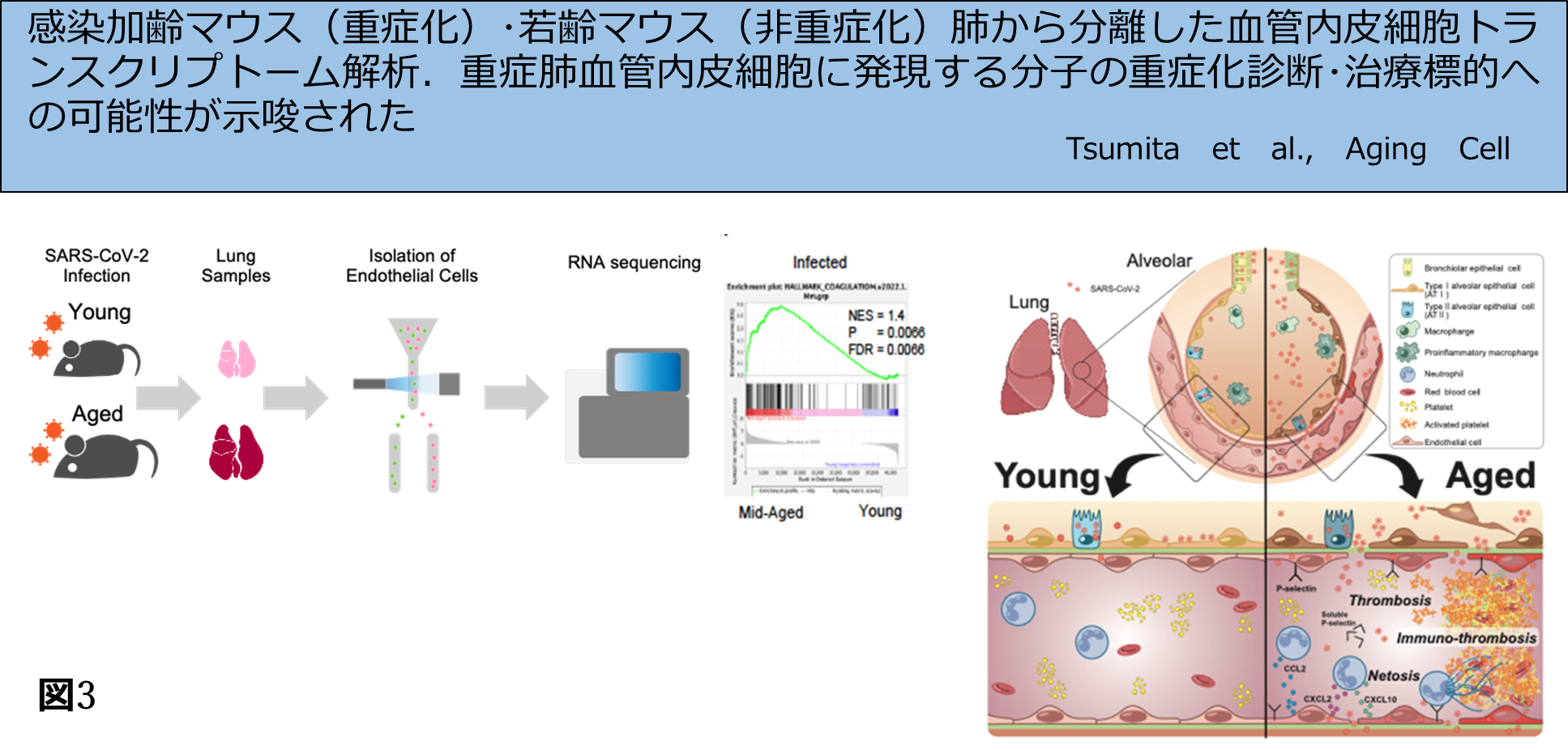
人獣共通感染症国際共同研究所の澤先生グループらと連携し、加齢マウスのみが重症化して死亡するマウス馴化SARS-CoV-2ウイルスを用いて、感染後重症化した加齢マウスの肺血管内皮細胞を分離し、重症化しない若齢マウス肺からも同様に血管内皮細胞を分離しそれぞれのトランスクリプトームを網羅的に比較した。加齢血管内皮細胞による血小板や免疫細胞活性化亢進機構を見出し、重症化には血管の加齢変化が重要であることを報告した(Tsumita et al, Aging Cell 2023, e14050, doi: 10。1111/acel. 14050, 本学プレスリリースhttps://www.hokudai.ac.jp/news/2023/12/post-1366.html)。重症肺炎の診断マーカーと治療薬標的分子の同定も行った(図3)。現在、 原島グループと連携し、阻害剤や分子のsiRNAの肺送達DDSによる治療実験を行っている。