-
薬学研究院 研究内容
ナノ医療グループ
ナノDDSに基づく個別化ナノ医療
本取組は2009年度より開始した最先端異分野融合研究「血管を標的とする革新的医薬分子送達法の基盤技術の確立」に始まり、薬学研究院に未来創剤学研究室を創設し、血管を標的とする革新的医薬分子送達法の確立を進めてきた。2014年度から「血管を標的とするナノ医療の実用化」に継続している。2019年度より「血管を標的とするナノ医療の実装~Personalized Nanomedicineの北大ブランド化~」として、薬学研究院の未来創剤学、歯学研究院の血管生物学、工学研究院の生物計測化学の3グループでコアを形成し、実用化へ向けた研究を開始した。未来創剤学研究室は、薬剤分子設計学研究室と密接な連携のもとに、血管を標的とする個別化ナノ医療の実用化を進める。以下に、2009年~2018年の研究成果を簡潔にまとめる。
- がんグループ:畠山浩人特任助教(米国留学を経て、現千葉大学准教授)をリーダーとして、腫瘍及び腫瘍血管を標的とするDual-ligand systemの開発を進めた。畠山特任助教が米国留学を機に、櫻井遊特任助教がリーダーとなり、血管生物学研究室と連携して、biglycanを標的とする核酸(siRNA)ナノ医療の開発を進めた。さらに、腫瘍の微小環境のリモデリングによるナノ医療の最適化も進めた。
- 肝臓グループ:林泰弘特任助教(米国留学を経て、現バイエル社)をリーダーとして、肝臓血管内皮細胞を標的とする能動的送達システムを開発した。2014年より佐藤悠介特任助教がリーダーとなり、pH-応答性カチオニック脂質(YSK脂質)を設計・合成し、東京都医学総合研究所の小原道法博士と共同で、C型肝炎治療、B型肝炎治療の開発を進めた。2016年より佐藤助教(薬剤分子設計学)はYSK脂質の構造最適化を図るため、ライブラリー化を進め、高活性のCL4H6の探索に成功した(ED50 = 0.0025 mgsiRNA/kg)。
- 脂肪グループ:梶本和昭特任准教授(現産総研主任研究員)がリーダーとして、脂肪血管内皮細胞をを標的とするPTNP(Prohibitin-targeted nano particle)の開発を進めた。リガンドグループと連携して、脂肪血管を標的とするアプタマーリガンドを探索した。2016年より、イクラミ・カリル特任助教がリーダーを引き継ぎ、脂肪への薬物送達システムの開発を進めている。
- リガンドグループ:兵藤守特任助教(現名古屋工業大学講師)がリーダーとなり、SELEX法によるがん及び脂肪血管に対する新規アプタマーリガンドの探索を進めた。
腫瘍血管を標的としたがん免疫療法を実現するナノDDSの開発
我々はこれまでに、腫瘍血管に発現しているαVβ3インテグリンに選択的に結合するcyclic RGDペプチドをMENDに修飾したcRGD-MENDを開発し、血管内皮増殖因子(VEGF)受容体を標的としたsiRNAを搭載することで腫瘍の微小環境をリモデリングすることに成功するとともに、抗腫瘍活性を相乗的に増強させた。また、膜融合性ペプチドであるGALAペプチドを修飾したMEND(GALA-MEND)が肺の血管内皮細胞に高効率で取り込まれることを見出し、CD31を標的としたsiRNAを搭載したGALA-MENDはメラノーマ肺転移の血管新生を阻害することで顕著な抗腫瘍活性を誘導することに成功している。
抗PD-1抗体に代表される免疫チェックポイント阻害療法の成功はがん治療に革命をもたらしたが、抗PD-1療法の有効率は20-30%であり、抵抗性を示す患者に対する新しいがん免疫療法の開発が急務である。抗PD-1療法抵抗性のメカニズムの1つに腫瘍血管内皮細胞が関与していることが知られている。本研究では、血管内皮標的化MENDであるcRGD-MENDやGALA-MENDを基盤技術とし、腫瘍血管内皮細胞の機能をリモデリングすることで抗PD-1療法抵抗性を克服する新しいがん免疫療法の開発とその実用化を目指している。
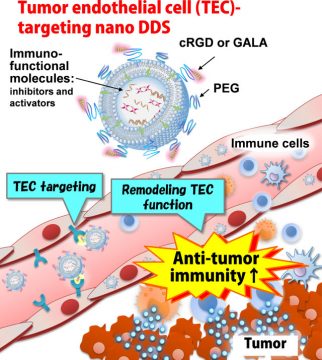
腫瘍血管を標的としたナノDDSによるがん免疫療法
メタボリック症候群を根治する革新的ナノ医療の実現
我々はこれまでに、prohibitinを認識して脂肪血管を選択的に標的化可能なprohibitin-targeted nanoparticle(PTNP)を開発し、細胞のアポトーシスを誘導するペプチドあるいはタンパク質を搭載することで脂肪血管のアポトーシスを誘導し、顕著な抗肥満効果を誘導した。また、脂肪血管を標的化可能な独自のアプタマー型リガンドの同定にも成功した。さらに、薬物の細胞質送達のカギとなる独自のpH感受性カチオン性脂質ライブラリの構築により、優れた安全性と肝臓における世界トップクラスのsiRNA送達効率を達成している。
メタボリック症候群は肥満を起点とし、高血糖や高血圧などの危険因子の増加から最終的には心筋梗塞や脳卒中などの致命的な合併症を引き起こすリスクを高める病態であり、これはメタボリックドミノと言われている。肥満はメタボリックドミノの最上流に位置しており、これを治療可能な技術の開発は急務と言える。本研究では上述の独自技術を基盤とし、脂肪および肝臓血管内皮細胞のアポトーシスや機能リモデリングを誘導することでメタボリック症候群を克服する革新的ナノ医療の実用化を目指している。
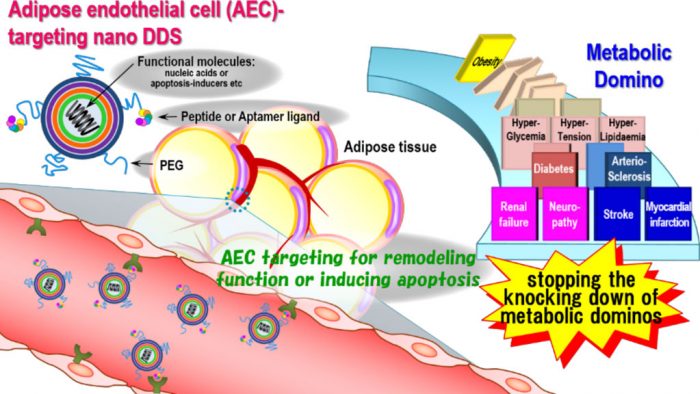
メタボリック症候群を克服するナノ医療の実用化
脳への分子送達を実現するナノDDSの開発
脳神経疾患 (アルツハイマー病、ミトコンドリア病など)および脳腫瘍など脳機能障害の原因は多岐にわたるが、これらの根本治療薬の開発は進んでいない。脳機能障害を主訴とする種々の疾患を治療するためには、治療分子を①脳組織への分布、②標的細胞への導入、さらには、③標的オルガネラへの送達を可能とする分子送達技術が必要不可欠である。脳には血管内皮細胞が密着する脳血液脳関門 (BBB, blood brain barrier)が存在するため、静脈投与経路では低分子であっても脳実質への移行性は極めて低い。そのため、本プロジェクトではBBBを標的とする新規リガンド並びにBBBを透過可能な新規リガンドの探索を行う(1)。さらに、脳神経細胞ならびに脳腫瘍細胞に親和性のあるMultifunctional envelope-type nano device (MEND)の開発も行い、脳への分子送達を実現するナノDDSへと発展させる(2)。また、標的オルガネラとして脳疾患に寄与する事も報告されているミトコンドリアへの分子送達(3)を進める予定である。
本研究で開発する脳へのアクセスを可能とするミトコンドリア標的型ナノDDSは、根本的な治療が難しい脳機能障害性疾患の治療・疾患解明に大きく貢献する事が期待される。
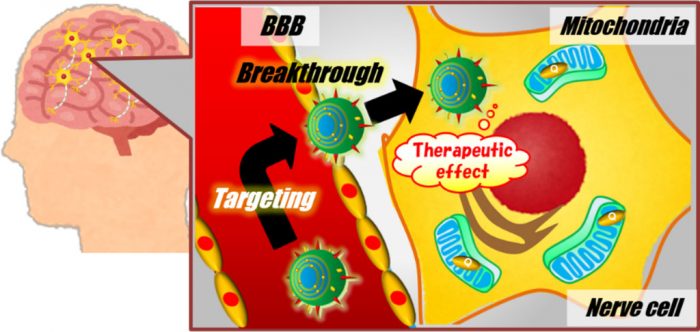
脳機能障害性疾患の治療