-
工学研究院 研究内容
マイクロ流路グループ
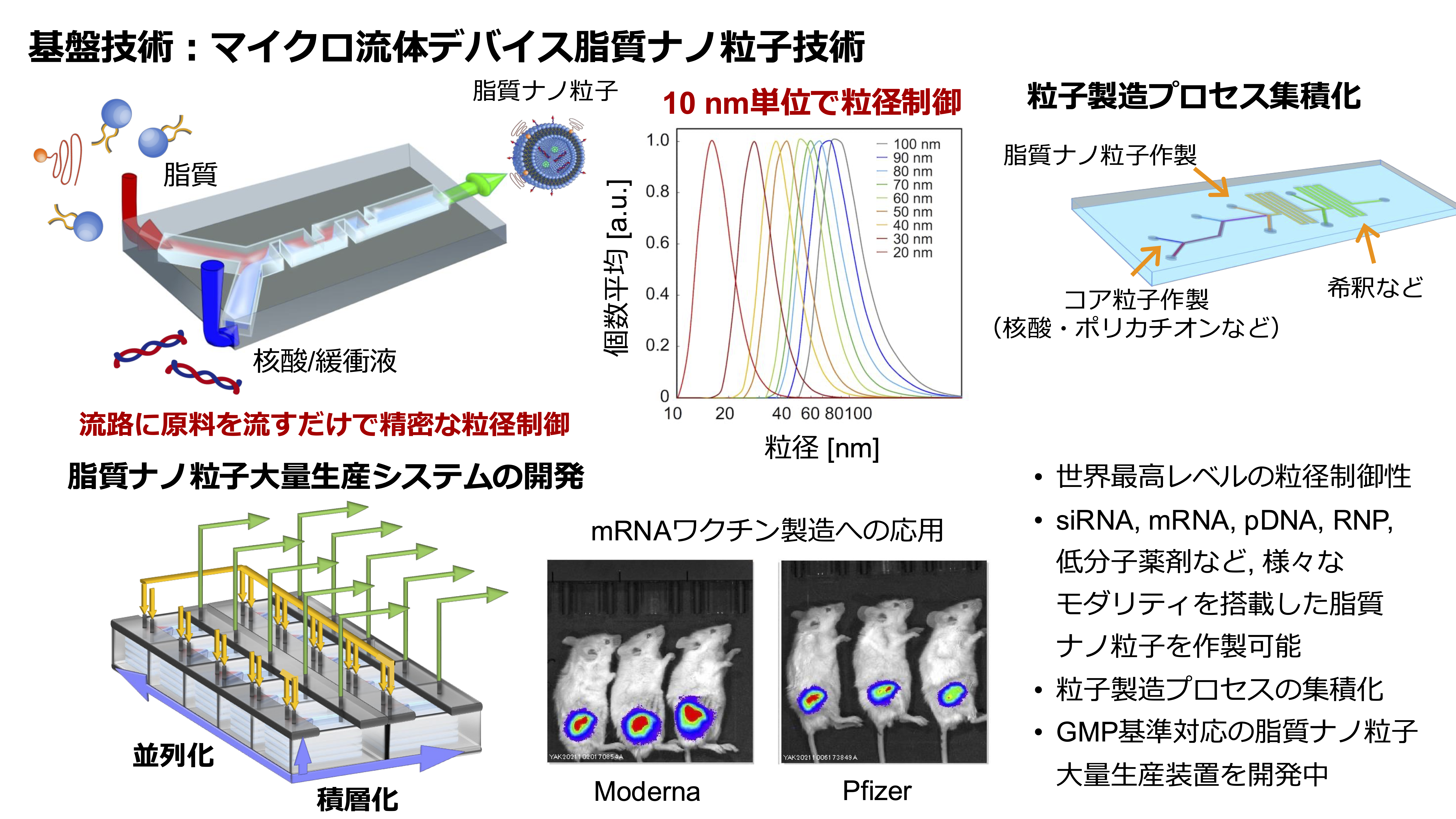
脂質ナノ粒子の粒径を任意のサイズで
精密に作製できるデバイス開発
医薬品分野を中心に粒径を精密に制御された脂質ナノ粒子製剤の需要が高まっている。特に、薬物送達システム(Drug Delivery System: DDS)技術を利用した医薬品において、ナノ粒子の大きさによって送達される臓器や薬効が異なることが報告されている。
この課題を解決するために、マイクロ流体デバイスチームでは、脂質ナノ粒子の粒径を任意のサイズで精密に作製できるデバイス開発に取り組んでいる。脂質ナノ粒子は、脂質/アルコール溶液と核酸などを含む核酸水溶液を迅速に希釈することが重要である。これまでに、当チームでは、マイクロミキサー構造を有する脂質ナノ粒子作製用のマイクロ流体デバイスを開発した(iLiNP(invasive Lipid Nanoparticle Production)。iLiNPデバイスは、中性リン脂質であるPOPC(1-Palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine)のナノ粒子の粒径を10 nm間隔で精密に制御することに成功している。また、核酸搭載脂質(siRNA、mRNA)ナノ粒子のほか、高分子ミセルナノ粒子を精密に粒径制御して作製することも可能である。
本プロジェクトでは、iLINPデバイスによる脂質ナノ粒子の大量生産プロセスの確立、ガラス製iLINPデバイスの開発、ナノ粒子の作製プロセスを高効率化した新規デバイスの開発などに取り組み、社会実装を見据えて研究を展開する。
本事業の成果
原島先生と樋田先生が推進してきた、第一期「血管を標的とする革新的医薬分子送達法の基盤技術の確立」(2009年度~2013年度)、第二期「血管を標的とするナノ医療の実用化」(2014年度~2018年度)に続く、第三期「血管を標的とするナノ医療の実装~Personalized Nanomedicineの北大ブランド化~」に参画させていただいた。真栄城を中心にして、原島先生のグループのDDSを高効率・高性能に作製できるマイクロ流体デバイス技術の開発と、樋田先生のグループのがん研究を推進するためのマイクロ流体デバイスの開発、マイクロ流体デバイスによる脂質ナノ粒子やポリマーナノ粒子の製造技術に関する研究開発を進めた。
本プロジェクトは原島先生と樋田先生が推進する研究の第三期にあたり、非常に高い目標を設定した。具体的なKPIとして、①Top10%被引用論文の割合35%、②大型共同研究(年間500万円以上)2件、③産業創出講座1件を掲げた。プロジェクトに参画するメンバー全員がこれらの目標を共有し、同じ方向を目指して取り組んだ結果、研究活動には一層の緊張感と集中力が生まれた。特に、年度ごとの研究成果を定量的に評価し、その結果を次年度の予算配分に反映させるという新しいシステムを導入したことは、これまでにない画期的な試みであった。すべてのKPIに貢献することが理想的ではあるが、研究開発のステージや研究内容によっては達成が難しい場合もあった。それでも、各グループが最大限の努力を重ねた結果、すべてのKPIを達成することができたのは、非常に誇るべき成果である。
2019年度~2023年度の成果
1.マイクロ流体デバイスによる脂質ナノ粒子の製造法の確立
既に特許として出願済みであったバッフル構造を持つマイクロ流体デバイス(iLiNP®デバイス)を基盤として、それぞれの目的に対して最適化したデバイスを開発した。原島先生のグループとの連携により、ミトコンドリアへのコエンザイムQ10の送達(Hibino M et al., J Pharm Sci 108: 2668-2676, 2019; Hibino M et al., Sci Rep 13: 6961, 2023)肝臓へのmRNAの送達(Hashiba A et al., J Control Release 327: 467-476, 2020; Sato Y et al., J Control Release 348: 648-659, 2022)、HBV感染細胞へのゲノム編集因子CRISPR/Cas9 ribonucleoprotein(RNP)送達(Sato Y et al., J Control Release 330: 61-71, 2021)への応用に成功した。iLiNPデバイスの高性能化として、二次希釈機能を集積化したデバイスの開発(Kimura N et al., ACS Appl Mater Interfaces 12: 3411-3420, 2020)やより粒径分布の狭い脂質ナノ粒子を作製可能な3DiLiNPデバイス(Kimura N et al., RSC Adv 11: 1430-1439、2021)を開発した。また、iLiNPデバイスによる疎水性薬剤を内包したポリマーナノ粒子の作製技術(Bao Y et al., PLOS ONE 17: e0271050, 2022; Bao Y et al., ACS Omega 7: 33079-33086, 2022)、脂質ナノ粒子の処方スクリーニング技術(Matsuura-Sawada Y et al., ACS Appl Eng Mater 1: 278‐286, 2023)、大量生産技術の開発(Matsuura-Sawada Y, et al., ACS Appl Nano Mater 5: 7867-7876, 2022)に成功した。信越化学工業株式会社と連携することで脂質ナノ粒子の大量生産システムの開発(Maeki M et al., Appl Mater Today 31: 101754)にも成功し、GMP製造装置の開発を進めている。さらに、放射光の小角X線散乱測定ビームラインとマイクロ流体デバイスを組み合わせて、脂質ナノ粒子の生成プロセスをリアルタイムで観測するための測定システムを構築した(Maeki M et al., Nanoscale Adv 6: 2166-2176, 2024)。その他にも、サイズの大きなプラスミドDNA(15 kbp)(Maeki M et al., ACS Appl Mater Interfaces 16: 2110-2119, 2023)の高効率な送達やエクソソーム様脂質ナノ粒子(Kimura N et al., ACS Appl Bio Mater 4: 1783-1793, 2021)の開発などにも成功している。DDS分野で権威のある雑誌Journal of Controlled Releaseにマイクロ流体デバイスによるmRNA内包脂質ナノ粒子の作製に関する総説(Maeki et al., J Control Release 344: 80-96, 2022 Top1%引用論文)を執筆した。
樋田先生のグループとの連携により、SARS-CoV-2抗体の迅速検査技術(Nishiyama K et al., Biosens Bioelectron 190: 113414, 2021)や血中循環腫瘍細胞の回収デバイスの開発(投稿準備中)に成功した。また、マイクロ流体デバイスにより微量検体を迅速かつ高感度に計測するためのさまざまなフォーマットの検査システムの開発に成功した(Komatsu T et al., ACS Sens 5: 1287-1294, 2020; Nishiyama K et al., Sens Actuators B 326: 128982, 2021; Komatsu T et al., Biosens Bioelectron 195: 113631, 2022など)。
本プロジェクトの5年間の特筆すべき成果として、Top10%被引用論文を12報(内Top1%被引用論文2報)発表することができた。本プロジェクトで得られた研究成果に基づき、新たな提案により真栄城がJST・さきがけ(2019~2023年)、渡慶次が科研費基盤研究(S)(2024年~)に採択された。人材育成の観点からも成果があり、真栄城は2021年4月より、北海道大学大学院工学研究院の准教授に昇進した。これらの研究により、真栄城が令和6年度文部科学大臣表彰若手科学者賞を受賞した。