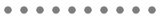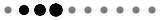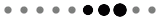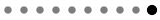-
薬学研究院 研究内容
ナノ医療グループ
ナノDDSに基づく個別化ナノ医療
本取組は2009年度より開始した最先端異分野融合研究「血管を標的とする革新的医薬分子送達法の基盤技術の確立」に始まり、薬学研究院に未来創剤学研究室を創設し、血管を標的とする革新的医薬分子送達法の確立を進めてきた。2014年度から「血管を標的とするナノ医療の実用化」に継続している。2019年度より「血管を標的とするナノ医療の実装~Personalized Nanomedicineの北大ブランド化~」として、薬学研究院の未来創剤学、歯学研究院の血管生物学、工学研究院の生物計測科学の3グループでコアを形成し、実用化へ向けた研究を開始した。未来創剤学研究室は、薬剤分子設計学研究室と密接な連携のもとに、血管を標的とする個別化ナノ医療の実用化を進める。
本事業から、KPI (Key Performance Indicator)を導入することになった。KPIは、
- Top10%被引用論文の割合35%
- 大型共同研究(年間500万円以上)2件
- 産業創出講座1件
のように設定した。いずれも高い目標であったが、自らを鼓舞するための目標設定と捉え、樋田先生と渡慶次先生の合意を得て、全員で共有した。全員が真剣に取り組めるようなシステムが必要となり、研究成果を定量的に評価して、次年度の研究費配分へフィードバックすることにした。KPIの目標達成と研究費配分をリンクすることで、参加者全員にとってKPIが自身の目標になった。
KPI-1: Citationを如何にして向上させるか、試行錯誤が続いた。当初は、citationの結果をただ眺めているだけであったが、Top10%被引用率の割合35%という目標を達成するためには積極的に何かする必要があった。試行錯誤の末に、self-citationは確実に数を増やすので、新たに原著論文を書く時、できるだけself-citationするように務めた。総説依頼はかなりの頻度で来ていたので、積極的にself-citationしてみると、翌年にTop10%被引用論文の数が上昇した。ただし、self-citationの効果が表れるのは最初の1~2年だけで、3年以降は他者からの引用が支配的であった。結果は、2019年から2023年の5年間で、論文総数99報、Top10%被引用論文40報、割合は40.4%であった。歯学と工学を含めた全体の平均値は38.5%で、目標の35%を超えることができた。
KPI-2: 2018年当時、年間500万円以上の大型共同研究を獲得することは非常に難しく、実例も乏しい状況であった。全く自信が無かったので、目標値2件と設定した。実際に始まると、2019年3件、2020年6件、2021年4件、2022年4件、2023年6件、のべ23件の大型共同研究が走った。2018年のオンパットロ®のFDAによる承認は、ナノ医薬品の実用化において変曲点となり、企業からの共同研究費は大型化した。我々自身も企業連携を行うとき、500万円を一つの基準として考えるようになった。勿論、200~300万円の共同研究も受け入れていたが、500万円以上、1000万円越えを目指すようにした。大型共同研究費の5年間の総額は、18件で3億3,172万円、一件当たり平均1,842万円であった(事業全体では23件で4億1,048万円、一件当たり平均1,784万円)。
KPI-3: 産業創出分野の創出は最大の壁であった。しかしながら、本事業は社会実装が究極の目標であり、また、大学側からの要請も感じていたので、1件を目標として掲げた(2018年)。7SEAS PROJECTはミトコンドリア治療の実現を目指すチームで、いつ頃からか、我々も連携していた。2018年に菅沼正司氏がルカサイエンス社を設立し、山田勇磨准教授と原島秀吉教授は科学顧問として協力してきた。これが幸運を招き、2020年よりルカサイエンス社が薬学研究院に産業創出分野として「バイオDDS実用化分野」を設置することとなり、山田勇磨准教授(現、教授)が研究代表者としてミトコンドリア送達・治療の実用化を加速した。ルカサイエンス社は菅沼氏を中心にプロ集団を形成し、ベンチャーキャピタルからシリーズA(10.3億円)、シリーズB(38.6億円)を獲得することに成功した。2024年度からは、新たに「細胞・オルガネラ製剤学分野」が創設され、原島秀吉卓越教授が研究代表者を兼務してミトコンドリア送達・治療の実用化を継続している。
1.独自のイオン化脂質ライブラリーを基盤とした高分子送達
【2019年度~2023年度の成果】
佐藤を中心とした研究グループでは、siRNA、mRNA等の核酸やゲノム編集因子の送達効率および標的多様性を最大化させるためのイオン化脂質ライブラリーの開発と本技術を基盤とした製剤開発を進めた。
既に物質特許として出願済みであったイオン化脂質YSK12を基盤として親水性頭部および疎水性足場構造の組み合わせにより多様な化学構造を有する体系的なイオン化脂質ライブラリーを構築した。その中のCL4H6は初めにその優れた性能が見いだされたイオン化脂質であり、世界トップクラスの効率で肝臓へsiRNAを導入できるとともに優れた生分解性による高い安全性が示された(Sato Y et al., J Control Release 295: 140-152, 2019)。CL4H6は肝へのmRNA(Hashiba A et al., J Control Release 327: 467-476, 2020)およびゲノム編集因子CRISPR/Cas9 ribonucleoprotein(RNP)送達(Onuma H et al., J Control Release 255: 406-416, 2023)への応用に成功するとともに、製剤処方の最適化により腫瘍関連マクロファージへのsiRNA送達による細胞極性変化誘導とがん治療への応用(Shobaki N et al., J Control Release 325: 235-248, 2020)や脾臓樹状細胞へのmRNA送達によるmRNAがんワクチンへの応用(Okuda K et al., J Control Release 348: 648-659, 2022)、さらには血小板へのmRNA送達(Leung J et al., Sci Adv 9: eadi0508, 2023)等、多岐に亘る成果をもたらした。JSR株式会社と連携することでCL4H6の製造技術の開発に成功し、同社より試験研究用に製造販売されている。また、酸乖離定数が比較的高いイオン化脂質CL15A6やCL15H6は肝線維症モデルにおける活性化肝星細胞への優れたsiRNAおよびmRNA導入を実現し、難治性の肝線維性疾患治療への可能性を開いた(Younis MA et al., J Control Release 353: 685-698, 2023, Younis MA et al., J Control Release 361: 592-603, 2023)。さらに、後述の中村グループとの連携により、酸乖離定数が最も高いイオン化脂質CL1H6はヒトNK細胞に対する世界トップクラスの効率のsiRNAおよびmRNA導入を実現した。このように、特性の異なる脂質のライブラリー化により多様な用途にそれぞれ最適な脂質の提供が可能となった。また、本脂質ライブラリーを基盤として詳細な構造-物性-活性相関研究も進め、疎水性足場構造の分岐構造がLNP構造安定性や膜融合活性を最大化するメカニズム(Hashiba H et al., Small Sci 3: 2200071, 2023)やRNP送達への応用による肝臓での98%を超える非常に優れた遺伝子ノックアウトの実現(Onuma H et al., iScience 27: 110928, 2024)、分岐足場鎖長による臓器選択的mRNA送達(Hashiba H et al., Nano Lett 24: 12758-12767, 2024)に加え、親水性頭部構造改変によるmRNA-LNP製剤の熱安定性の大幅な向上技術の提案(Hashiba H et al., Commun Biol 7: 556, 2024)等に成功している。
これらの成果により2023年のField-Weighted Citation Impact(FWCI)は3.98に達し、10% Top Citation Percentileは56.6%(30報)を記録し(Elseveir社SciValより)、当該分野において高い評価を受けている。また、20を超える特許を出願し、3件の大型研究を含め30社以上の国内外企業と連携して創薬を目指した産学連携を推進している。また、アカデミア間連携によりAMED事業において難治性疾患治療への応用を精力的に進め、技術の社会実装を目指している。現在はナノ粒子-生体間相互作用に着眼した肝臓外組織への薬物送達技術の開発を中心に研究を推進している。
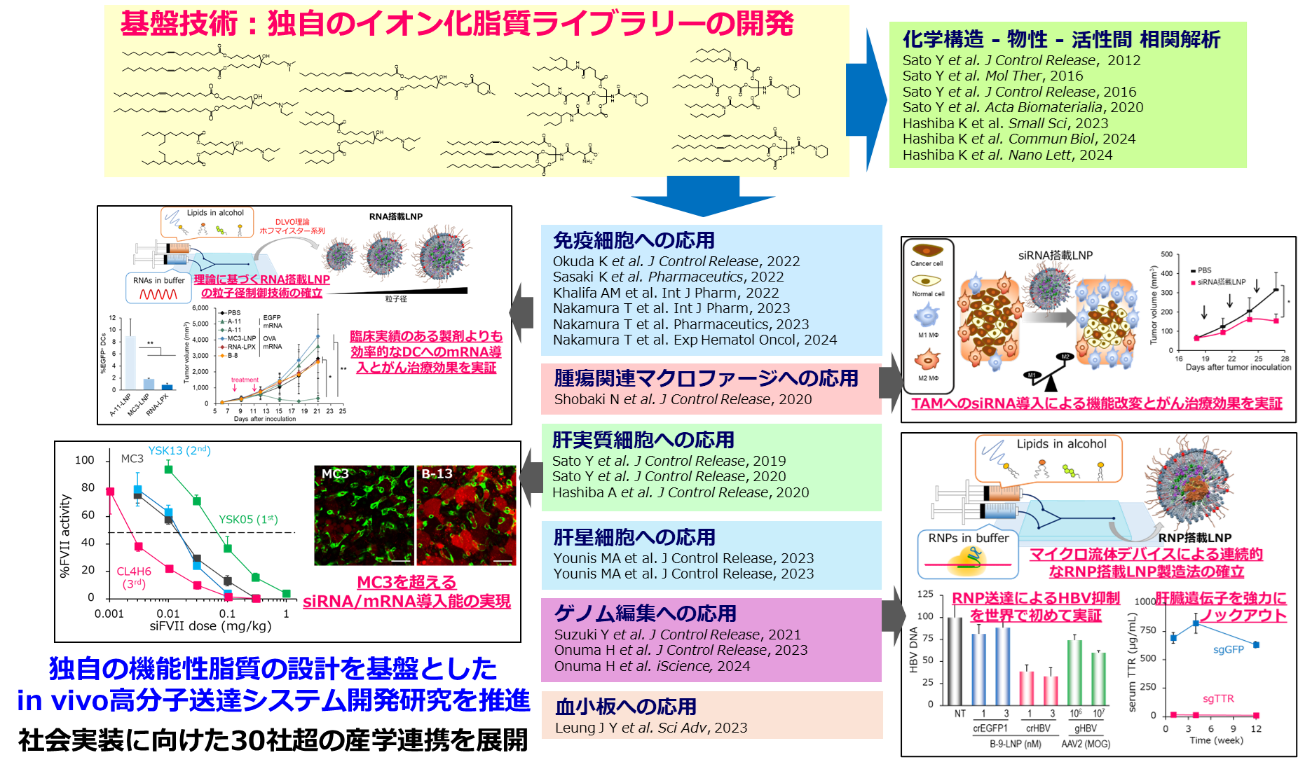
2.ナノDDSを基盤としたがん免疫治療: ナノがん免疫治療
【2019年度~2023年度の成果】
中村を中心とした研究グループでは、がん免疫応答を最大化するためのナノDDS開発と新しいナノがん免疫療法に貢献するメカニズムの解明を進めた。
まず、我々はマイクロ流路デバイスを用いて粒子サイズと電荷が異なるLNPを調製し、免疫細胞の活性化の場であるリンパ節送達に適したLNP特性を世界に先駆けて報告した(Nakamura T*, et al., Mol Pharm 17: 944-953, 2020)。この成果は、薬剤学領域のTop1%引用論文として高く評価されている。また、中村はDDS分野で権威ある総説雑誌Advanced Drug Delivery Reviewsのguest editorに選出され、リンパ節送達の特集記事を編集した(Nakamura T*, et al., Adv Drug Deliv Rev 167: 78-88, 2020 Top10%引用論文)。並行して、腫瘍内の免疫状態を簡便に把握し、ナノDDS設計へと還元するための独自の遺伝子パネルを開発することでナノがん免疫療法の開発を加速させた(Nakamura T*, et al., J Control Release 345: 200-213, 2022 Top10%引用論文)。
免疫不応答による免疫チェックポイント阻害剤耐性がんに対し、我々が開発したstimulator of interferon genes(STING)経路を活性化するアジュバント搭載したLNP(STING-LNP)を併用することで、相乗的に抗腫瘍活性が増加し、耐性がんに対する有効性が認められた。さらに、STING経路を介したnatural killer(NK)細胞の活性化が腫瘍内の免疫状態を改善し、耐性を克服するというメカニズムも明らかにすることができた(Nakamura T*, et al., J Immunother Cancer 9: 2002852, 2021)。本論文は、腫瘍学領域のTop1%論文として高く評価されている。また、国内製薬企業と共同研究へと発展し、STING-LNPの特性がどのようにがん免疫応答に影響を調べる実用化研究を進めた(成果: Endo R, et al., J Control Release 372: 609-618, 2024)。さらに、非常に興味深いことに、STING-LNPと腫瘍血管内皮細胞における遺伝子ノックダウンを併用することで、急速な腫瘍血管破壊を誘導し、非常に強力な抗腫瘍活性を示すことを発見した。新規のメカニズムによる腫瘍血管破壊であり、ヒト腫瘍に対しても有効であることから、創薬シーズ化を目指した研究を進めている。
上述の成果より、がん免疫療法におけるNK細胞の有用性が明らかになったことからNK細胞を直接遺伝子レベルで機能改変するためのLNPの開発を進め、ヒトNK細胞に対して世界トップクラスの効率でsiRNAやmRNAを導入することに成功した(Nakamura T*, et al., Int J Pharm 609: 121140, 2021; Nakamura T*, et al., Int J Pharm 636: 122810, 2023)。この成果をもとに、海外ベンチャー企業とヒトNK細胞へのmRNA送達に関する実用化研究を進めている。
本プロジェクトの5年間の特筆すべき成果として、Top1%引用論文を3報(原著2報、総説1報)発表することができた。また大型予算の獲得へも繋がり、AMED創薬基盤推進研究事業(代表: 中村)に採択され、サブセットレベルで細胞を識別可能な世界初のactive targeting技術の開発に成功している(PCT/JP2024/036074)。さらに、科研費基盤研究(A)の採択(代表: 中村)にも繋がり、NK細胞を標的とした新しいナノがん免疫療法の開発に挑んでいる。人材育成の観点からも成果があり、ナノがん免疫療法の研究グループを率いていた中村は2024年10月より、金沢大学医薬保健研究域薬学系の教授のポジションを得た。
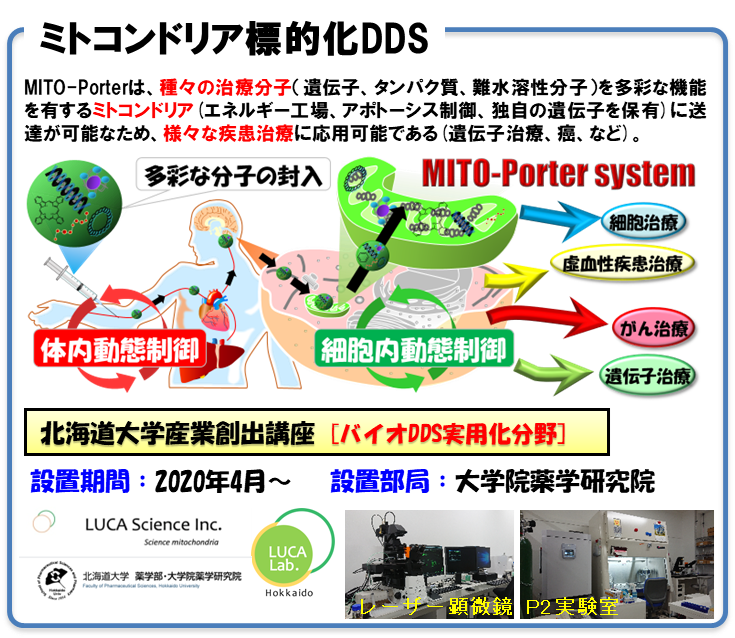
3.ミトコンドリア標的型DDSを基盤とするオルガネラ治療
【2019年度~2023年度の成果】
山田を中心とした研究グループでは、多彩な機能を有するオルガネラであるミトコンドリアを標的としたDDS (MITO-Porter)を基盤とするオルガネラ治療に取り組んだ。オルガネラ標的型DDSの社会実装を研究の最終ゴールに据え、臨床医・基礎研究者と連携し、Proof of concept (POC)取得に関する自主臨床研究・応用研究を推進してきた。期間中、特に精力的に取り組んできた癌治療、細胞治療に関する研究成果を記載する。
癌治療: 癌細胞のエネルギー工場であるミトコンドリアを破壊する治療抵抗性癌に対する新たな治療戦略の検証を進めた。薬剤性耐性癌細胞であるOSRC2細胞を用いた検討を行い、抗癌剤搭載MITO-Porterを投与した際に、ミトコンドリア機能の低下、殺細胞効果、担癌モデル動物を用いた抗腫瘍効果も観察しており、本戦略が治療抵抗性癌に対する有効な治療法になり得る事を示している。本研究に対して2022年に米国薬剤師会よりEbert Prize Award (米国で現存する最古の薬学賞)が授与され、国際的にも高い評価を受けた。癌細胞ミトコンドリアを標的とした「光治療」の検証も行った。癌細胞 (in vitro)を用いた光治療の実績を有しており (既存薬の1/10の投与量で有意な治療効果)、担癌モデル動物を用いた癌光治療の検証 (in vivo)においても良好な成果を得ている(Satrialdi et al., Chem. Commun. 2020/ Top10%)。北海道大学病院・臨床研究開発センターの協力の基、GMP製剤の準備・CROを活用した非臨床研究の計画を立案中である。これらの研究を推進するための研究資金調達のため、社会への情報発信も兼ねるクラウドファンディング活動 (2020年)に参画した (北海道大学2例目)。「研究活動」とは全く異なる挑戦に大いに苦戦したが、当初目標額を大幅に上回る10,119,000円のご支援を頂いた。「資金調達」以外にも、患者・家族との交流、学生・市民への情報発信が実現できた (アウトリーチ活動)。本研究に対して2023年に旭化成創剤開発技術賞が授与され、製剤・創剤開発の観点で高い評価を受けた。
細胞治療: 酸化ストレス発生源であり、細胞内ATP産生を担うミトコンドリアを活性化した心筋前駆細胞 (Cardiac progenitor cell (CPC)) (MITO cell)を移植に用いる事で、荒廃した心不全環境においても有効な心筋幹細胞移植が可能になると考えた。マウス由来CPCのミトコンドリアに活性化分子を送達したミトコンドリア活性化CPC (MITO-CPC)の構築し、ドキソルビシン心筋症および心筋虚血再灌流モデルマウスを作成し、MITO cellを用いた細胞移植の治療効果を評価した。その結果、生存率、心機能 (心エコー法)ともにMITO cell移植群は従来の細胞移植法と比較して有効な治療効果を認めた (Sasaki D et al., Sci Rep. 2022/ Top10%)。これらの研究成果は、心疾患の診断・治療の経験が豊富な北海道大学病院・小児循環器班・医師らと進めた実績である。MITO cellを用いた細胞治療の臨床応用に向け、ヒトの心臓から単離した細胞を用いて、ヒト由来のMITO cell (human MITO cell)を作成し、細胞移植治療を行う自主臨床研究を実施した (臨床研究番号016-0507、北海道大学病院)。human MITO cellを虚血再灌流モデルラットに投与し、心機能、心筋線維化の評価および心筋メタボローム解析を行い、human MITO cellの移植は既存の細胞移植と比較し治療効果が増強されることが示された (Shiraishi M et al., J. Control. Release 2024/ Top10%)。本研究は、2024年度北海道大学拠点/橋渡し研究プログラム/シーズA (AMED)に採択されており、研究をさらに加速させていく所存である。
本プロジェクトの5年間の特筆すべき成果として、我々のDDSをコア技術とて設立されたルカ・サイエンス株式会社の協力を得て、2020年に産業創出講座 [バイオDDS実用化分野] を設置したことである。これまで取り組んできたミトコンドリア標的型DDS研究に加え、ルカ・サインエス社と連携したミトコンドリア創剤研究が相互に研究を発展させ、多くの競争的資金 (代表者: JST・創発, 基盤(A), 他)、企業大型共同研究 (8件)を獲得した (5年総額約2.1億円)。人材育成の観点からも成果があり、山田は2023年4月より、北海道大学・薬学部の教授のポジションを得た。さらに、5年間の本プロジェクト成果 (過去5年間 Top10%論文11報 (35.5%))が評価され、新たな産業創出講座 (細胞・オルガネラ製剤学分野)を原島教授と共に設置するに至った。