Research
研究内容
2. 生理活性脂質スフィンゴシン 1-リン酸の生理機能と代謝
スフィンゴ脂質代謝産物であるスフィンゴシン 1-リン酸(S1P)は血漿中に数百 nM の濃度で存在する脂質メディエーターである。S1P は細胞膜上に存在する S1P 受容体のリガンドとして細胞運動制御,アクチン骨格形成,細胞増殖,接着結合形成など様々な細胞応答を引き起こす1, 2)。S1P 受容体として S1PR1 から S1PR5 の5種類が知られているが,S1PR1 が生理的に最も重要である。これらは互いにホモロジーの高い G 蛋白質共役型受容体であり,それぞれが特異的な G 蛋白質を介して細胞内にシグナルを伝達する(図 5)。
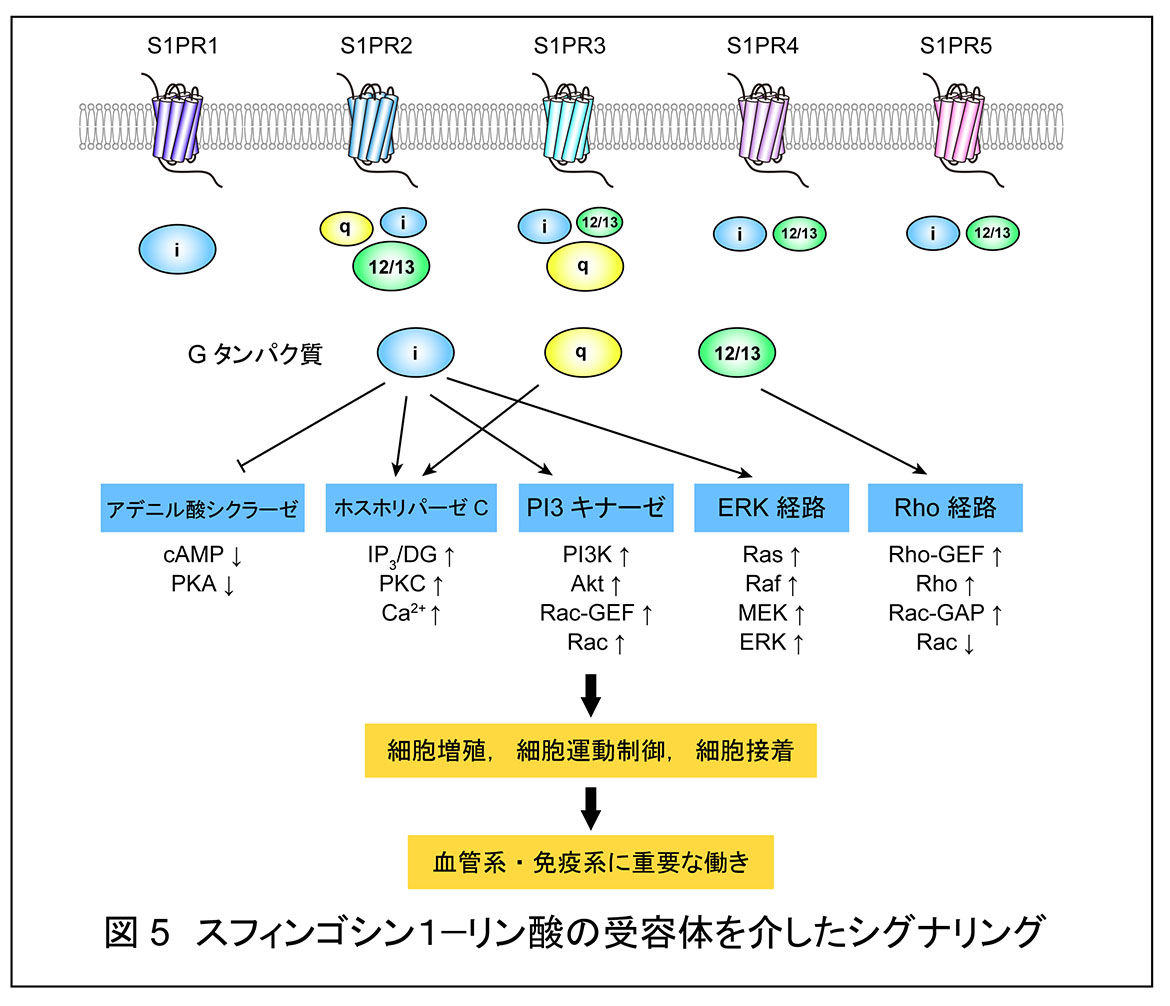
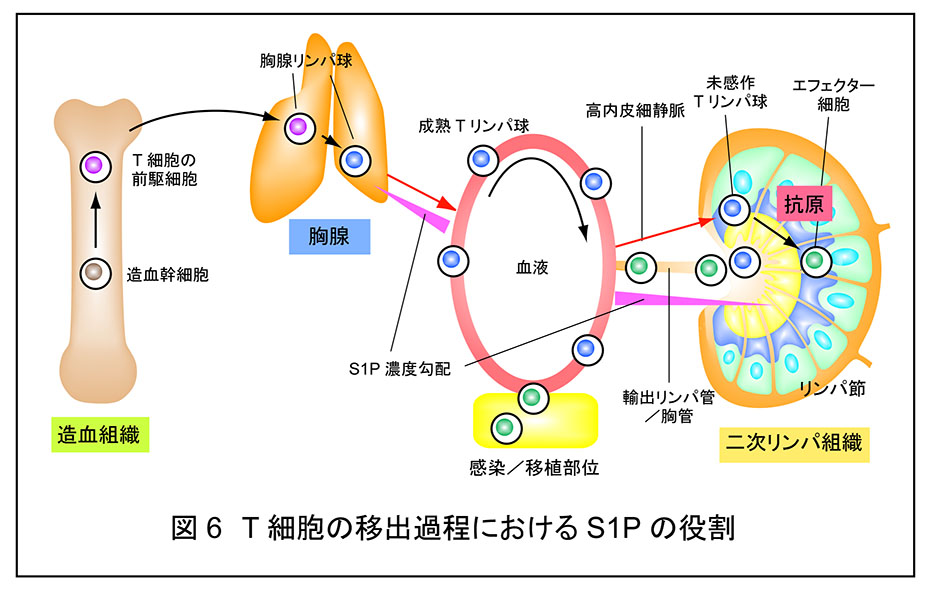
S1P は血漿中に多く見られることから,血漿に接している血管内皮細胞とリンパ球への効果が生理的に重要である。前者(血管系)においては胎生期の血管形成,後者(免疫系)においてはリンパ球の胸腺・二次リンパ組織からの移出過程に重要である。T リンパ球は胸腺で成熟後,血液へと移出し,血液と二次リンパ組織中を循環する(図 6)。未感作 T リンパ球は二次リンパ組織へ移行後,抗原を提示されなかった場合はそのまま血液へと戻るが,抗原提示細胞によって提示された抗原を認識した場合はエフェクター細胞へと分化,増殖後,血液へと戻る。胸腺及び二次リンパ組織からの移出には,S1P および S1PR1が中心的な働きをしている2, 3)。リンパ球上に発現している S1PR1 が胸腺−血漿間,あるいは二次リンパ組織−リンパ液−血漿間の S1P 濃度勾配に依存した化学遊走を引き起こす。あるいは二次リンパ組織からの移出を制御している内皮細胞上の S1PR1 が,内皮細胞間の接着結合を調節している。もし,リンパ球上の S1PR1 がなくなるか,S1P 濃度勾配が失われると T リンパ球は胸腺あるいは二次リンパ組織から移出できなくなり,循環 T リンパ球が減少して免疫抑制が引き起こされる。多発性硬化症の治療薬である新規免疫調整剤フィンゴリモド(開発コード名 FTY720)は生体内でリン酸化されてフィンゴリモドリン酸に変換後,S1PR1 のリガンドとして作用し,S1P よりも強力に細胞表面からダウンレギュレート(細胞表面へリサイクルさせずにリソソームで分解)させることで免疫抑制を引き起こす。
上述のように,組織−血漿間の S1P 濃度勾配維持は極めて重要である。一般的に組織内の S1P 濃度は低く保たれているが,これは合成酵素であるスフィンゴシンキナーゼよりも,分解酵素である S1P リアーゼ,S1P ホスファターゼの活性が優勢であるからである。一方,血漿中の S1P 濃度は赤血球や内皮細胞からの供給と血漿に接する細胞への取り込みあるいは細胞表面のホスファターゼによる分解のバランスによって規定されている。生化学研究ではこれまで,これらの S1P/長鎖塩基代謝酵素と動態に関して以下のような知見を得た。
- 1)ヒト S1P ホスファターゼ遺伝子として SGPP2/SPP2 を同定し,その遺伝子産物の酵素学的な性質を明らかにした4)。
- 2)S1P ホスファターゼと S1P リアーゼは共に小胞体に局在するが,その活性中心はそれぞれ小胞体膜の内腔側と細胞質側に位置し,空間的に隔てられている5, 6)。
- 3)赤血球は S1P 分解酵素を欠いているため,S1P を多く蓄積しており,血漿中 S1P の供給源として重要な役割を果たす7)。
- 4)血漿フィンゴリモドリン酸の供給源としては赤血球ではなく,血小板が働いている8)。
- 5)フィンゴリモドリン酸は血管内皮細胞膜上のリン脂質ホスファターゼ PLPP/LPP により脱リン酸化され,不活性化される9)。
- 6)マウススフィンゴシンキナーゼ1の転写バリアント(SPHK1a,SPHK1b)は,細胞内局在,オリゴマー状態,翻訳後修飾,安定性など酵素学的性質が全く異なる10)。
- 7)細胞外の S1P のほとんどは細胞表面のリン脂質ホスファターゼ PLPP による脱リン酸化後に細胞内に取り込まれるが,一部は S1P のまま直接取り込まれ,特に赤血球において顕著である11)。また,この S1P の取り込みには SPNS2 と MFSD2B が関わる。これらは S1P を細胞内から細胞外へ放出するトランスポーターとして知られていたが,本研究によって細胞膜を介した両方向の輸送が可能なチャネルタイプのトランスポーターであることが明らかとなった。
- 8)細胞外の長鎖塩基は細胞内に速やかに取り込まれるが,この取り込みはアシル CoA 合成酵素(酵母では Faa1 と Faa4,哺乳類では ACSL)依存的である12)。これらのアシル CoA 合成酵素は脂肪酸トランスポーターとして同定された経緯があり,これらが長鎖塩基トランスポーターとして機能する可能性がある。
- 9)酵母において長鎖塩基を細胞内から細胞外へ放出するトランスポーターとして Rsb1 を同定した13)。
- 10)酵母の S1P 代謝酵素の解析を行い,酵母スフィンゴシンキナーゼの多彩な翻訳後修飾(パルミトイル化,リン酸化,ユビキチン化)を見出し,それらによる細胞内局在・安定性制御機構を明らかにした14-16)。
代謝中間体としてのスフィンゴシン 1-リン酸
S1P は細胞外で脂質メディエーターとして機能するが,産生場所は細胞内である。ほとんど全ての細胞が S1P を産生するが,一部の細胞(血球や血管/リンパ管内皮細胞等)のみが S1P を細胞外へ放出する。他の細胞では(おそらく S1P を放出する血管内皮細胞においても)大部分の S1P は細胞外へ放出されることなく,細胞内で代謝される。S1P が細胞内でセカンドメッセンジャーとして機能するという説もあるが,実際のところは細胞内の S1P には代謝中間体としての役割が大きいように思われる。スフィンゴ脂質のセラミド部分は分解過程(セラミダーゼによる分解)で,脂肪酸と長鎖塩基(S1P の場合はスフィンゴシン)に変換される。スフィンゴシンは再度脂肪酸と結合してセラミドとなり,スフィンゴ脂質へ再利用される(Salvage 経路)か,S1P を介してパルミトイル CoA にまで代謝される(図7)。パルミトイル CoA はその後大部分(直接あるいは脂肪酸伸長または不飽和化後)がグリセロ脂質へと代謝されるが,一部は β 酸化やスフィンゴ脂質合成にも利用される。後者の長鎖塩基分解経路はスフィンゴ脂質の長鎖塩基部分をグリセロ脂質へと代謝する唯一の経路である。そのため,S1P を介したこの代謝経路はスフィンゴ脂質のホメオスタシスに重要であり,経路の遮断は正常な細胞機能を損なわせる。実際,スフィンゴシン代謝経路において最初の不可逆反応を触媒する S1P リアーゼ SGPL1 遺伝子の変異は遺伝性疾患(ステロイド抵抗性ネフローゼ症候群)を引き起こす。また,Sgpl1 をノックアウト(KO)したマウスでは,肝臓での代謝異常,肺,心臓,尿管,骨の形態異常などの様々な障害が見られ,寿命も約1ヶ月と短い。S1P(長鎖塩基 1-リン酸)の代謝中間体としての役割は,酵母から哺乳類までスフィンゴ脂質が存在する全ての生物で保存された普遍的なものである。一方,脂質メディエーターとしての機能は進化の過程では脊索動物以降に獲得した比較的新しいものである。
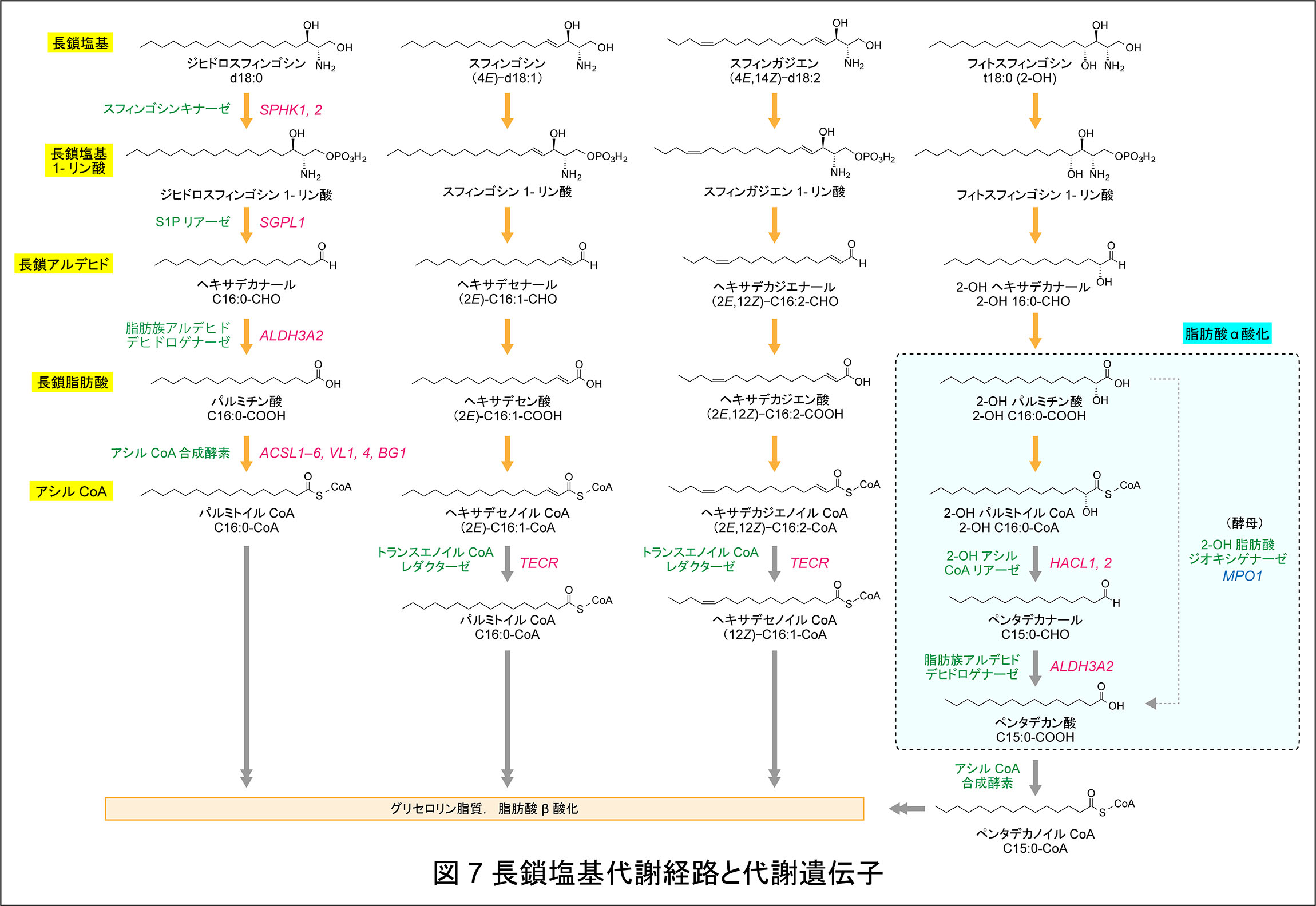
スフィンゴシンの分解経路において,S1P リアーゼの産物であるトランス-2-ヘキサデセナール以降の代謝経路と関与する遺伝子は長年不明であった。生化学研究室ではこの解明に取り組み,スフィンゴシンだけでなく,ジヒドロスフィンゴシン,フィトスフィンゴシン,スフィンガジエンを含めた長鎖塩基分解経路の全容を解明することに成功した(図7)17-24), 37)。長鎖塩基分解経路では,長鎖塩基の種類に関わらず,リン酸化(長鎖塩基 1-リン酸産生),開裂(長鎖アルデヒド産生),酸化(長鎖脂肪酸産生),CoA 付加(アシル CoA 産生)という共通ステップが存在する(図7,オレンジ色矢印)。生化学研究室ではこの共通反応の後半の2つの反応に関わる酵素,すなわち酸化反応における脂肪族アルデヒドデヒドロゲナーゼ(動物,ALDH3A2;酵母,Hfd1),CoA 付加反応におけるアシル CoA 合成酵素(動物,ACSL1−6, ACSVL1, 4, ACSBG1;酵母,Faa1, Faa4)を明らかにした25, 26)。最も単純な長鎖塩基であるジヒドロスフィンゴシンはこの分解経路によってパルミトイル CoA へ変換される。C4−5 位間にトランス二重結合を持つスフィンゴシンもジヒドロスフィンゴシンと同様にパルミトイル CoA へと代謝されるが,そのためには飽和化の反応が必要である。生化学研究室ではトランス-2-エノイル CoA レダクターゼ(TECR)がトランス-2-ヘキサデセノイル CoA からパルミトイル CoA への反応を触媒することを見出した27)。同様にスフィンガジエンも代謝の過程で C4−5 位間のトランス二重結合が飽和化され,シス-12-ヘキサデセノイル CoA となる37)。長鎖塩基の代謝に関与することが明らかとなった脂肪族アルデヒドデヒドロゲナーゼ遺伝子 ALDH3A2 はシェーグレン・ラルソン症候群(SLS)の原因遺伝子である。SLS は皮膚魚鱗癬,精神遅滞,痙性対麻痺を特徴とする遺伝性疾患であり,ALDH3A2 の基質アルデヒドの蓄積が SLS 発症の原因であると考えられている。生体内のどの脂肪族アルデヒドが SLS 発症の主要な原因となっているかは未だ不明であるが,我々の結果はスフィンゴシン代謝経路由来のヘキサデセナールが SLS 発症に関与する可能性を示すものである。
ALDH3A2 は S1P 由来のヘキサデセナールの代謝に中心的な役割を果たすが,ALDH3A2 が欠損した細胞でも完全には S1P 代謝経路は遮断されない。これは ALDH3A2 と相同性を示す他の脂肪族アルデヒドデヒドロゲナーゼが働くからである。生化学研究室では ALDH3B1,B2,B3 が ALDH3A2 と同様にヘキサデセナールを含む長鎖アルデヒドに高い活性を示すことを明らかにした28, 29)。これらの脂肪族アルデヒドデヒドロゲナーゼの基質特異性は類似しているが,細胞内局在は異なっている(ALDH3A2,小胞体;ALDH3B1と ALDH3B3,細胞膜;ALDH3B2,脂肪滴)。S1P のグリセロリン脂質への代謝は全て小胞体で行われるので,S1P 代謝への寄与は小胞体に局在する ALDH3A2 が最も高い。Aldh3a2 KO マウスを解析したところ,表皮全体での脂肪族アルデヒドデヒドロゲナーゼ活性に影響は見られず,皮膚バリア形成,水分蒸散量にも変化はなかった30)。このことはマウスにのみ存在する Aldh3b2 による重複した活性に起因しており,Aldh3a2 Aldh3b2 二重 KO マウスでは皮膚バリア異常が見られた31)(詳細は「4. 皮膚におけるセラミドとバリア形成」を参照)。
Aldh3a2 の欠損はマウスの脳においては脂肪族アルデヒドデヒドロゲナーゼ活性を野生型マウスの約 3 割に低下させ,軽度な運動機能異常を引き起こした32)。この KO マウスの脳ではミエリンの機能維持に重要なスフィンゴ脂質である 2-ヒドロキシガラクトシルセラミドの量が低下していた。この原因として,Aldh3a2 KO マウス中でトランス-2-ヘキサデセナールなどの脂肪族アルデヒドが蓄積し,脂肪酸 2-水酸化酵素 FA2H の基質ポケットに入り込んで活性中心残基を攻撃することが示唆された。
4 位に水酸基を有する長鎖塩基フィトスフィンゴシンは哺乳類では表皮,胃,小腸,腎臓,肺などの特異的な組織に存在し,酵母では主要な長鎖塩基である。生化学研究室ではフィトスフィンゴシンがスフィンゴシンやジヒドロスフィンゴシンとは異なり,奇数鎖脂肪酸(主にペンタデカン酸)へと代謝されることを見いだした(図 7)。フィトスフィンゴシン代謝の前半はスフィンゴシンやジヒドロスフィンゴシンと同様であり,長鎖塩基 1-リン酸(フィトスフィンゴシン 1-リン酸),長鎖アルデヒド(2-ヒドロキシヘキサデカナール),長鎖脂肪酸(2-ヒドロキシパルミチン酸)へと変換される。フィトスフィンゴシンにはもともと 4 位に水酸基があるため,この代謝の過程で 2 位に水酸基をもつ脂肪酸(2-ヒドロキシパルミチン酸)が産生される。この水酸基の存在がこの後の代謝を特徴的なものとしており,2-ヒドロキシパルミチン酸は α 酸化されることで炭素数を 1 つと水酸基を失う。生化学研究室では酵母のフィトスフィンゴシン代謝経路において α 酸化に関わる因子として Mpo1 を同定することに成功した33)。Mpo1 は原核生物から下等真核生物まで保存されたタンパク質ファミリー DUF962(DUF: Domain of Unknown Function)のメンバーである。このファミリーのメンバーはこれまで 3,000 以上見つかっているが,機能が明らかとなったのは Mpo1 が初めてである。その後の解析から Mpo1 は鉄イオンを捕因子とし,2-ヒドロキシ脂肪酸を 1 炭素短い非水酸化脂肪酸へ変換する新しいタイプのジオキシゲナーゼであることを明らかにした34)。Mpo1 の活性には3つの高度に保存されたヒスチジン残基が必要であり,これらが鉄イオンに配位すると予測された35)。Mpo1 はフィトスフィンゴシンから由来する長鎖の 2-ヒドロキシ脂肪酸だけでなく,極長鎖の2-ヒドロキシ脂肪酸も基質とする35)。MPO1 遺伝子の欠損は通常の生育条件下では生育速度に影響を与えないが,小胞体ストレスや炭素飢餓条件下では生育の遅延を引き起こす34, 35)。
長鎖塩基の代謝経路と代謝遺伝子群の殆どは酵母から哺乳類まで保存されている。しかし,フィトスフィンゴシン代謝経路中の脂肪酸 α 酸化だけは酵母と哺乳類で異なっている。哺乳類には Mpo1 ホモログが存在しない。その代わりに哺乳類では,2-ヒドロキシパルミチン酸が 2-ヒドロキシパルミトイル CoA へと変換後,主に 2-ヒドロキシアシル CoA リアーゼ HACL2 (部分的にHACL1)によってペンタデカナールへと開裂し,さらに脂肪族アルデヒドデヒドロゲナーゼ ALDH3A2 によってペンタデカン酸へと変換される。HACL2 は生化学研究室で同定した新規 2-ヒドロキシアシル CoA リアーゼであり,小胞体に局在する36)。これまで脂肪酸 α 酸化はペルオキシームで行われるというのが通説であったが,生化学研究室は小胞体での脂肪酸 α 酸化の存在を初めて明らかにした。奇数鎖脂肪酸についてはこれまでも,量は少ないものの生体には存在することが知られていた。しかし,これまでは奇数鎖脂肪酸の由来として,脂肪酸合成酵素がアセチル ACP の代わりにプロピオニル ACP を用いた結果生じると考えられてきた。我々の結果はそれ以外にもフィトスフィンゴシンや脂肪酸の 2 位の水酸化で生じた 2-ヒドロキシ脂肪酸の α 酸化で奇数鎖脂肪酸が生じることを示している。事実,Hacl2 KO マウスの脳では奇数鎖モノヘキソシルセラミド(大部分がガラクトシルセラミド)が野生型マウスの 4 分の 1 に,胃では奇数鎖セラミドが約半分に減少する38)。脂肪酸 α 酸化の生理的役割は奇数鎖脂肪酸を産生することではなく,むしろ,そのままではグリセロ脂質への代謝や β 酸化できない 2-ヒドロキシ脂肪酸を代謝可能な分子へと変換するために存在すると思われる。生体分子は一般的に合成と分解のバランスでホメオスタシスを維持しており,その破綻は様々な細胞機能障害や疾患を引き起こす。生化学研究室の見いだした長鎖塩基の代謝経路あるいはフィトスフィンゴシンの奇数鎖脂肪酸へと代謝経路は,分解という観点からスフィンゴ脂質のホメオスタシス維持の分子メカニズムを明らかにしたものである。
研究業績
- Kihara A, Mitsutake S, Mizutani Y, Igarashi Y (2007) Metabolism and biological functions of two phosphorylated sphingolipids, sphingosine 1-phosphate and ceramide 1-phosphate. Prog Lipid Res, 46, 126-144. Review
- 木原章雄 (2006) 多彩な機能を持つスフィンゴ脂質,スフィンゴシン(長鎖塩基)1-リン酸の生理的役割,生成/代謝,細胞内動態. 生化学, 78, 725-737. Review
- Kihara A, Igarashi Y (2008) Production and release of sphingosine 1-phosphate and the phosphorylated form of the immunomodulator FTY720. Biochim Biophys Acta, 1781, 496-502. Review
- Ogawa C, Kihara A, Gokoh M, Igarashi Y (2003) Identification and characterization of a novel human sphingosine-1-phosphate phosphohydrolase, hSPP2. J Biol Chem, 278, 1268-1272.
- Kihara A, Sano T, Iwaki S, Igarashi Y (2003) Transmembrane topology of sphingoid long-chain base-1-phosphate phosphatase, Lcb3p. Genes Cells, 8, 525-535.
- Ikeda M, Kihara A, Igarashi Y (2004) Sphingosine-1-phosphate lyase SPL is an endoplasmic reticulum-resident, integral membrane protein with the pyridoxal 5'-phosphate binding domain exposed to the cytosol. Biochem Biophys Res Commun, 325, 338-343.
- Ito K, Anada Y, Tani M, Ikeda M, Sano T, Kihara A, Igarashi Y (2007) Lack of sphingosine 1-phosphate (S1P)-degrading enzymes in erythrocytes, a potential major source of plasma S1P in addition to platelets. Biochem Biophys Res Commun, 357, 212-217.
- Anada Y, Igarashi Y, Kihara A (2007) The immunomodulator FTY720 is phosphorylated and released from platelets. Eur J Pharm, 56, 106-111.
- Yamanaka M, Anada Y, Igarashi Y, Kihara A (2008) A splicing isoform of LPP1, LPP1a, exhibits high phosphatase activity toward FTY720 phosphate. Biochem Biophys Res Commun, 375, 675-679.
- Kihara A, Anada Y, Igarashi Y (2006) Mouse sphingosine kinase isoforms SPHK1a and SPHK1b differ in enzymatic traits including stability, localization, modification, and oligomerization. J Biol Chem, 281, 4532-4539.
- Goto H, Miyamoto M, Kihara A. (2021) Direct uptake of sphingosine-1-phosphate (S1P) independent of phospholipid phosphatases. J Biol Chem, 296, 100605.
- Narita T, Naganuma T, Sase Y, Kihara A. (2016) Long-chain bases of sphingolipids are transported into cells via the acyl-CoA synthetases. Sci Rep, 6, 25469.
- Kihara A, Igarashi Y (2002) Identification and characterization of a Saccharomyces cerevisiae gene, RSB1, involved in sphingoid long-chain base release. J Biol Chem, 277, 30048-30054.
- Kihara A, Kurotsu F, Sano T, Iwaki S, Igarashi Y (2005) Long-chain base kinase Lcb4 Is anchored to the membrane through its palmitoylation by Akr1. Mol Cell Biol, 25, 9189-9197.
- Iwaki S, Kihara A, Sano T, Igarashi Y (2005) Phosphorylation by Pho85 cyclin-dependent kinase acts as a signal for the down-regulation of the yeast sphingoid long-chain base kinase Lcb4 during the stationary phase. J Biol Chem, 280, 6520-6527.
- Sano T, Kihara A, Kurotsu F, Iwaki S, Igarashi Y (2005) Regulation of the sphingoid long-chain base kinase Lcb4p by ergosterol and heme: studies in phytosphingosine-resistant mutants. J Biol Chem, 280, 36674-36682.
- 木原章雄 (2019) スフィンゴ脂質恒常性維持のためのセラミド分解経路. セラミド研究の新展開 〜基礎から応用へ〜 (セラミド研究会編,食品化学新聞社), 32-43. Review
- Kihara A (2016) Synthesis and degradation pathways, functions, and pathology of ceramides and epidermal acylceramides. Prog Lipid Res, 63, 50-69. Review.
- Kihara A (2015) Sphingolipid metabolism via sphingosine 1-phosphate and its role in physiology pathology, and nutrition. " Bioactive lipid mediators: current reviews and protocols (Yokomizo T, Murakami M eds.)", Springer Japan, Tokyo. pp 127-138. Review
- 木原章雄 (2014) スフィンゴ脂質の代謝と関連疾患. 医学のあゆみ, 248, 1112-1118. Review.
- 木原章雄 (2016) 明らかとなったスフィンゴ脂質の代謝経路:フィトスフィンゴシン代謝による奇数鎖脂肪酸の産生. 化学と生物, 54, 75-76 Review.
- Kihara A (2014) Sphingosine 1-phosphate is a key metabolite linking sphingolipids to glycerophospholipids. Biochim Biophys Acta, 1841, 766-772. Review.
- 木原章雄 (2013) スフィンゴシン1-リン酸の代謝経路の全容と中間代謝体としての重要性. 生化学, 85, 553-557. Review
- 木原章雄 (2013) スフィンゴシン1-リン酸の代謝経路. 遺伝子医学 MOOK, 24, 175-179. Review
- Nakahara K, Ohkuni A, Kitamura T, Abe K, Naganuma T, Ohno Y, Zoeller RA, Kihara A (2012) Sjögren-Larsson syndrome gene encodes a hexadecenal dehydrogenase of the sphingosine 1-phosphate degradation pathway. Mol Cell, 46, 461-471.
- Ohkuni A, Ohno Y, Kihara A (2013) Identification of acyl-CoA synthetases involved in the mammalian sphingosine 1-phosphate metabolic pathway. Biochem Biophys Res Commun, 442, 195-201.
- Wakashima T, Abe K, Kihara A (2014) Dual functions of the trans-2-enoyl-CoA reductase TER in the sphingosine 1-phosphate metabolic pathway and in fatty acid elongation. J Biol Chem, 289, 24736-24748.
- Kitamura T, Naganuma T, Abe K, Nakahara K, Ohno Y, Kihara A (2013) Substrate specificity, plasma membrane localization, and lipid modification of the aldehyde dehydrogenase ALDH3B1. Biochim Biophys Acta, 1831, 1395-1401.
- Kitamura T, Takagi S, Naganuma T, Kihara A (2015) Mouse aldehyde dehydrogenase ALDH3B2 is localized to lipid droplets via two C-terminal tryptophan residues and lipid modification. Biochem J, 465, 79-87.
- Naganuma T, Takagi S, Kanetake T, Kitamura T, Hattori S, Miyakawa T, Sassa T, Kihara A. (2016) Disruption of the Sjögren-Larsson syndrome gene Aldh3a2 in mice increases keratinocyte growth and retards skin barrier recovery. J Biol Chem, 291, 11676-11688.
- Nojiri K, Fudetani S, Arai A, Kitamura T, Sassa T, Kihara A. (2021) Impaired skin barrier function due to reduced ω-O-acylceramide levels in a mouse model of Sjögren-Larsson syndrome. Mol Cell Biol, 41, e0035221.
- Kanetake T, Sassa T, Nojiri K, Sawai M, Hattori S, Miyakawa T, Kitamura T, Kihara A. (2019) Neural symptoms in a gene knockout mouse model of Sjögren-Larsson syndrome are associated with a decrease in 2-hydroxygalactosylceramide. FASEB J, 33, 928-941.
- Kondo N, Ohno Y, Yamagata M, Obara T, Seki N, Kitamura T, Naganuma T, Kihara A (2014) Identification of the phytosphingosine metabolic pathway leading to odd-numbered fatty acids. Nat Commun, 5, 5338.
- Seki N, Mori K, Kitamura T, Miyamoto M, Kihara A. (2019) Yeast Mpo1 is a novel dioxygenase that catalyzes the α-oxidation of a 2-hydroxy fatty acid in an Fe2+-dependent manner. Mol Cell Biol, 39, e00428-00418.
- Mori K, Obara T, Seki N, Miyamoto M, Naganuma T, Kitamura T, Kihara A. (2020) Catalytic residues, substrate specificity, and role in carbon starvation of the 2-hydroxy FA dioxygenase Mpo1 in yeast. J Lipid Res, 61, 1104-1114.
- Kitamura T, Seki N, Kihara A (2017) Phytosphingosine degradation pathway includes fatty acid α-oxidation reactions in the endoplasmic reticulum. Proc Natl Acad Sci USA , 114, E2616-E2623.
- Jojima K, Kihara A. (2023) Metabolism of sphingadiene and characterization of the sphingadiene-producing enzyme FADS3. Biochim Biophys Acta Mol Cell Biol Lipids, 1868, 159335.
- Mori K, Naganuma T, Kihara A. (2023) Role of 2-hydroxy acyl-CoA lyase HACL2 in odd-chain fatty acid production via α-oxidation in vivo. Mol Biol Cell, 34, ar85.
