<1> “核酸医薬”と“蛋白質医薬”の学問・研究面での融合イノベーションによる「次世代バイオ(バイオ融合)医薬品の開発を目指しています。 この研究を通しバイオ医薬のイノベーション・次世代の創薬研究リーダーを育成していきます。そこで次世代バイオ医薬開発に特化した3つの柱
- 大学院講義 総合バイオ医薬学講義の開講
- 産学官連携インターンシップ(国内)
- グローバル教育(海外の大学、企業へのインターンシップ・外国人講師による英語による講義)
を軸とする教育プログラムを確立していきます。
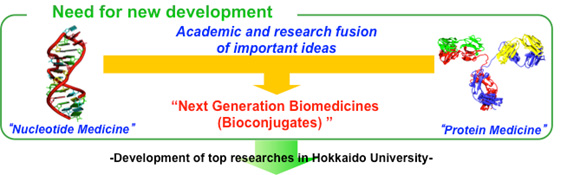
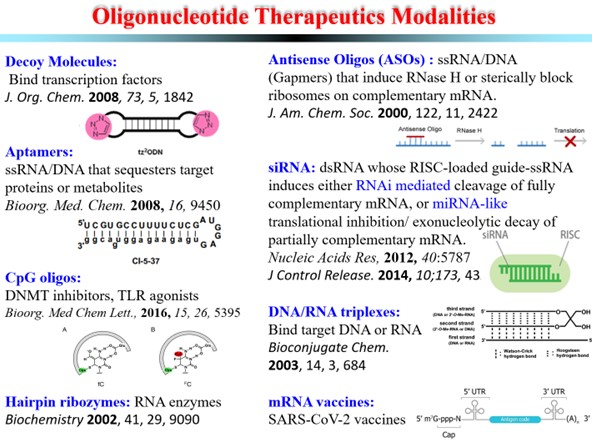
<2> 酸生体高分子のDNA (デオキシリボ核酸)やRNA(リボ核酸)は蛋白質に比較して低分子医薬品で標的しにくいが、薬物治療上で核酸を標的する新規創薬モビリティが求められている。我々は、新規創薬モダリティ高分子医薬品のmRNAワクチンや抗体―核酸医薬複合体を創出している。また、中分子医薬品のオリゴ核酸として化学修飾した一本鎖のギャプマー型アンチセンスオリゴ核酸(ASO)や二本鎖の短い干渉RNA(siRNA)の創出研究を注目している。更に、より良い薬物動態・薬力学性質を併せ持つ抗ウイルス薬や抗がん剤の低分子核酸医薬品にも注力している。最後に、医薬品化学の有機合成化学の側面に加え、生化学的実験による生物活性の評価も創薬センターバイオ医薬品部門内又は共同研究先で実施する。
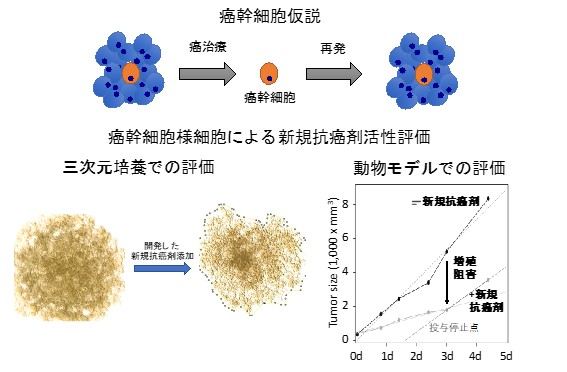
<3> 癌は日本における死亡原因の1位であり、治療法の開発が数多くなされているが、未だ根治させるのが難しい疾患の一つである。癌の成熟過程において、癌幹細胞は成熟癌細胞の根底に存在し、また、再発・転移の原因であると考えられている(癌幹細胞仮説)。そのため、癌幹細胞は自己複製能を持つとともに、抗癌剤や放射線への抵抗性を有しており、治療の際に残存しやすい。つまり、これを標的とした治療法を確立することで再発、転移のリスクの少ない根本的な癌治療へ繋がることが期待される。癌幹細胞研究が複数報告されているが、多くの報告は薬剤耐性株であり、これらが真にCSCなのかは未だ確証がない。近年、三次元培養による癌幹細胞調製法が報告されているが、高くとも40%程度しか癌幹細胞様細胞が含まれておらず、これらを標的として癌の発生研究や創薬を勧めるのは難しいと考えられる。そこで、我々は市販の癌細胞株にも癌幹細胞が極微量存在すると考え、抗癌剤や成長因子などの外部刺激を用いることなく癌幹細胞様細胞を調製し、高純度の癌幹細胞様細胞株の開発に成功した。この癌幹細胞様細胞を用いることで、癌の発生、成熟過程、転移機構などの疾患の本質の理解が進み、さらに創薬応用することで、癌根治療法の開発が行える。すでに創薬スクリーニングを実施し、小胞体に局在する酵素を標的とする化合物を見出しており、動物モデルを用いた評価を実施している。
<4> TRIM(Tripartite motif)ファミリーは、RING、B-box、Coiled-coilと呼ばれる3つのモチーフを共通して持つヒトで11クラス80種ものバリエーションを有するタンパク質である。その多くは、不要なタンパク質をユビキチン化することでプロテアソームを介して分解するE3ユビキチンリガーゼとして機能することが知られているが、主にユビキチン化を介して自然免疫応答、転写や細胞周期の制御、オートファジー・アポトーシス誘導、DNA修復など多岐にわたる細胞内恒常性維持に関わることも明らかになってきている。また、がん細胞の発生・増殖・転移、他のいくつかの遺伝疾患のマーカーとしての利用も期待されている。TRIMタンパク質をターゲットにした創薬に取り組むにあたり問題となるのが、その高次構造の報告数が少ないことである。タンパク質部分ごとに発現・精製された部分をX線(結晶)やNMR(溶液)を使って構造を解析した報告はあるが、各ドメインがそれぞれどのような位置に配され活性に寄与するのかといった情報を得るための分子全体についてはまだ報告がない。我々は、昆虫細胞を使って比較的大量かつ容易に発現・精製が可能なTRIM68をクライオ電子顕微鏡で観察し、単粒子解析によりその全体像を明らかにしようとしている。またこれと並行して、一般的なTRIMとは違った性質を持つ特殊なTRIMを選び、同様の手法で構造解析を試みている。